碳负离子:修订间差异
无编辑摘要 |
|||
| (未显示8个用户的9个中间版本) | |||
| 第5行: | 第5行: | ||
|G1=Chemistry |
|G1=Chemistry |
||
}} |
}} |
||
[[File:碳负离子. |
[[File:碳负离子.svg|thumb|right|100px|碳负离子]] |
||
'''碳负离子'''({{lang-en|Carbanion}}),又叫'''碳陰離子''',指的是含有一个连有三个[[基团]],并且带有一对[[孤对电子]]的[[碳]]。碳负离子带有一个孤立负电荷,通常是三角椎體构型,其中孤对电子占一个[[sp3杂化|sp<sup>3</sup>混成轨道]]。形式上,碳陰離子是含碳酸的共軛鹼: |
'''碳负离子'''({{lang-en|Carbanion}}),又叫'''碳陰離子''',指的是含有一个连有三个[[基团]],并且带有一对[[孤对电子]]的[[碳]]。碳负离子带有一个孤立负电荷,通常是三角椎體构型,其中孤对电子占一个[[sp3杂化|sp<sup>3</sup>混成轨道]]。形式上,碳陰離子是含碳酸的共軛鹼: |
||
| 第15行: | 第15行: | ||
* [[誘導效應]]。電荷會受鄰近的負電原子影響而穩定 |
* [[誘導效應]]。電荷會受鄰近的負電原子影響而穩定 |
||
* 帶電原子的混成。帶電原子[[混成]]後,[[S軌域]]的比例越大,碳陰離子就越穩定 |
* 帶電原子的混成。帶電原子[[混成]]後,[[S軌域]]的比例越大,碳陰離子就越穩定 |
||
* [[共振]]現象。共振可以穩定碳負離子,這也是為何[[芳香性| |
* [[共振]]現象。共振可以穩定碳負離子,這也是為何[[芳香性|芳香族]]的碳負離子會很穩定 |
||
碳陰離子在有機化學中擔任反應中間物 |
碳陰離子在有機化學中擔任反應中間物([[活性中間體]])的角色,比如[[E1cB反應]]與有機金屬化學中的[[格林尼亚反应]]。1984年,Olmstead介紹三苯甲基碳陰離子的鋰[[冠醚]]鹽,由[[三苯甲烷]]與[[正丁基鋰]]、[[12-冠-4]]反應產生。 |
||
[[file:TriphenylmethaneAnion.png|center|500px|triphenylmethane anion的形成]] |
[[file:TriphenylmethaneAnion.png|center|500px|triphenylmethane anion的形成]] |
||
在低溫下將三苯甲烷與融於THF的正丁基鋰反應,再加入12-冠-4產生紅色溶液與在-20℃下沉澱的鹽類複合物。中間的C-C鍵長145pm,苯基間的鍵角31.2°。與[[四甲基铵]]相比,螺旋槳型就不太明顯。探測溶液中碳負離子的其中一種方法是質子NMR。在DMSO中的環戊二烯的圖譜在5.50ppm有一個環戊二烯陰離子的峰值。 |
在低溫下將三苯甲烷與融於THF的正丁基鋰反應,再加入12-冠-4產生紅色溶液與在-20℃下沉澱的鹽類複合物。中間的C-C鍵長145pm,苯基間的鍵角31.2°。與[[四甲基铵]]相比,螺旋槳型就不太明顯。探測溶液中碳負離子的其中一種方法是質子NMR。在DMSO中的環戊二烯的圖譜在5.50ppm有一個環戊二烯陰離子的峰值。 |
||
==碳酸== |
==氢碳酸== |
||
帶有C-H的分子能經由丟出質子形成碳負離子。故有C-H鍵的烴類可以視作一種酸類,並有對應的pKa值。甲烷因pKa大到近56,相對於pKa 4.76的醋酸,通常甲烷就不視作酸類。相同的條件在判斷碳負離子的穩定度時,也能判斷出碳酸pKa的相對順序。藉由跟傳統酸類比較pKa值,可以判斷出特定化合物是否能溶於水中。下表為一些化合物的酸度,從甲烷開始,越往下酸度愈大。 |
帶有C-H的分子能經由丟出質子形成碳負離子。故有C-H鍵的烴類可以視作一種酸類,並有對應的pKa值。甲烷因pKa大到近56,相對於pKa 4.76的醋酸,通常甲烷就不視作酸類。相同的條件在判斷碳負離子的穩定度時,也能判斷出碳酸pKa的相對順序。藉由跟傳統酸類比較pKa值,可以判斷出特定化合物是否能溶於水中。下表為一些化合物的酸度,從甲烷開始,越往下酸度愈大。 |
||
{|align="center" class="wikitable" style="background: #ffffff; text-align: center;" |
{|align="center" class="wikitable" style="background: #ffffff; text-align: center;" |
||
|- |
|- |
||
!名字 |
|||
!name |
|||
!化学式 |
|||
!formula |
|||
!结构 |
|||
!structural formula |
|||
!pKa |
!pKa |
||
|- |
|- |
||
| 第41行: | 第41行: | ||
|[[環戊烷]] |
|[[環戊烷]] |
||
|C<sub>5</sub>H<sub>10</sub> |
|C<sub>5</sub>H<sub>10</sub> |
||
|[[Image: |
|[[Image:Cyclopentane v2.svg|40px]] |
||
|~ 45 |
|~ 45 |
||
|- |
|- |
||
| 第86行: | 第86行: | ||
|[[乙炔]] |
|[[乙炔]] |
||
|C<sub>2</sub>H<sub>2</sub> |
|C<sub>2</sub>H<sub>2</sub> |
||
|[[Image:Acetylene-CRC-IR-dimensions-2D. |
|[[Image:Acetylene-CRC-IR-dimensions-2D.svg|90px]] |
||
| 25 |
| 25 |
||
|- |
|- |
||
2023年7月18日 (二) 18:46的最新版本

碳负离子(英語:Carbanion),又叫碳陰離子,指的是含有一个连有三个基团,并且带有一对孤对电子的碳。碳负离子带有一个孤立负电荷,通常是三角椎體构型,其中孤对电子占一个sp3混成轨道。形式上,碳陰離子是含碳酸的共軛鹼:
- R3C-H + B− → R3C− + H-B
上式的B表示鹼。而碳陰離子在有機反應中扮演中間物的角色。
理論
[编辑]碳陰離子為親核試劑,其反應性與穩定度受許多因素影響。包含:
碳陰離子在有機化學中擔任反應中間物(活性中間體)的角色,比如E1cB反應與有機金屬化學中的格林尼亚反应。1984年,Olmstead介紹三苯甲基碳陰離子的鋰冠醚鹽,由三苯甲烷與正丁基鋰、12-冠-4反應產生。
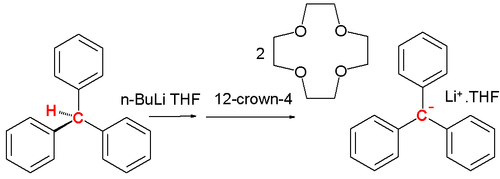
在低溫下將三苯甲烷與融於THF的正丁基鋰反應,再加入12-冠-4產生紅色溶液與在-20℃下沉澱的鹽類複合物。中間的C-C鍵長145pm,苯基間的鍵角31.2°。與四甲基铵相比,螺旋槳型就不太明顯。探測溶液中碳負離子的其中一種方法是質子NMR。在DMSO中的環戊二烯的圖譜在5.50ppm有一個環戊二烯陰離子的峰值。
氢碳酸
[编辑]帶有C-H的分子能經由丟出質子形成碳負離子。故有C-H鍵的烴類可以視作一種酸類,並有對應的pKa值。甲烷因pKa大到近56,相對於pKa 4.76的醋酸,通常甲烷就不視作酸類。相同的條件在判斷碳負離子的穩定度時,也能判斷出碳酸pKa的相對順序。藉由跟傳統酸類比較pKa值,可以判斷出特定化合物是否能溶於水中。下表為一些化合物的酸度,從甲烷開始,越往下酸度愈大。
| 名字 | 化学式 | 结构 | pKa |
|---|---|---|---|
| 甲烷 | CH4 | 
|
~ 56 |
| 乙烷 | C2H6 | 
|
~ 50 |
| 環戊烷 | C5H10 | ~ 45 | |
| 丙烯 | C3H6 | ~ 44 | |
| 苯 | C6H6 | ~ 43 | |
| Dimethyl sulfoxide/DMSO | (CH3)2SO | 
|
35.5 |
| 雙芬基甲烷 | C13H12 | 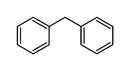
|
32.3 |
| 苯胺 | C6H5NH2 | 
|
30.6 |
| 三芬基甲烷 | C19H16 | 
|
30.6 |
| 乙醇 | C2H5OH | 29.8 | |
| 丙酮 | C3H6O | 
|
26.5 |
| 乙炔 | C2H2 | 
|
25 |
| 環戊二烯 | C5H6 | 
|
18 |
--以粗體字表示酸類
歷史
[编辑]1907年,碳陰離子在Clarke和Lapworth發表關於安息酸縮合反應機制的文章中首次出現。1904年,Schlenk從四甲基氯化铵與三苯甲基钠反應製備Ph3C-NMe4+以獲得五價氮。十年後,他證明出三苯甲基自由基如何藉由鹼金屬來減少碳離子。Wallis和Adams在1933年使用碳陰離子這個詞來表示帶有負電荷的碳離子。
連結
[编辑]参考资料
[编辑]- Harder, Sjoerd (2002). "Schlenk's Early “Free” Carbanions". Chemistry - A European Journal 8 (14): 3229–3232.
- Organic Chemistry - Robert Thornton Morrison, Robert Neilson Boyd
- The isolation and x-ray structures of lithium crown ether salts of the free phenyl carbanions [CHPh2]- and [CPh3]- Marilyn M. Olmstead, Philip P. Power; J. Am. Chem. Soc.; 1985; 107(7); 2174-2175.
- A Simple and Convenient Method for Generation and NMR Observation of Stable Carbanions. Hamid S. Kasmai Journal of Chemical Education • Vol. 76 No. 6 June 1999
- Equilibrium acidities in dimethyl sulfoxide solution Frederick G. Bordwell Acc. Chem. Res.; 1988; 21(12) pp 456 - 463
- The Configurational Stability of cis- and trans-2-Methylcyclopropyllithium and Some Observations on the Stereochemistry of their Reactions with Bromine and Carbon Dioxide Douglas E. Applequist and Alan H. Peterson J. Am. Chem. Soc.; 1961; 83(4) pp 862 - 865
- Cyclopropanes. XV. The Optical Stability of 1-Methyl-2,2-diphenylcyclopropyllithium H. M. Walborsky, F. J. Impastato, and A. E. Young J. Am. Chem. Soc.; 1964; 86(16) pp 3283 - 3288;
- Enantioselectivity determined by NMR spectroscopy after derivatization with Mosher's acid
- Preparation of Chiral -Oxy-[2H1]methyllithiums of 99% ee and Determination of Their Configurational Stability Dagmar Kapeller, Roland Barth, Kurt Mereiter, and Friedrich Hammerschmidt J. Am. Chem. Soc.; 2007; 129(4) pp 914 - 923; (Article)
