有机硼化合物:修订间差异
小 取消186.225.180.242(对话)的编辑;更改回Addbot的最后一个版本 |
|||
| (未显示3个用户的3个中间版本) | |||
| 第39行: | 第39行: | ||
有机硼化合物还可与[[有机钯化合物]]发生[[金属转移反应]]。该反应类型在[[铃木反应]]中被广泛应用。 |
有机硼化合物还可与[[有机钯化合物]]发生[[金属转移反应]]。该反应类型在[[铃木反应]]中被广泛应用。 |
||
=== |
=== 参与氧化还原反应 === |
||
混合硼烷,如[[9-BBN]]和[[三仲丁基硼氢化锂]](L-selectride)属于一类[[还原剂]]。例如羰基还原反应中的[[不对称催化剂]]就是[[CBS还原|CBS催化剂]]。该催化剂属有机硼催化剂,用于反应中与羰基氧原子配位。 |
混合硼烷,如[[9-BBN]]和[[三仲丁基硼氢化锂]](L-selectride)属于一类[[还原剂]]。例如羰基还原反应中的[[不对称催化剂]]就是[[CBS还原|CBS催化剂]]。该催化剂属有机硼催化剂,用于反应中与羰基氧原子配位。 |
||
三苯基硼或三(α-萘基)硼和钠汞齐反应,可以得到Na[BPh<sub>3</sub>]或Na<sub>2</sub>[BNp<sub>3</sub>](Np=萘基)。<ref>{{cite journal | last=Bent | first=Henry E. | last2=Dorfman | first2=Maurice | title=PENTAVALENT BORON | journal=Journal of the American Chemical Society | publisher=American Chemical Society (ACS) | volume=54 | issue=5 | year=1932 | issn=0002-7863 | doi=10.1021/ja01344a511 | pages=2132–2133}}</ref><ref>{{cite journal | last=Bent | first=Henry E. | last2=Dorfman | first2=Maurice | title=The Conductance of Non-aqueous Solutions. I. Sodium Triphenylboron and Disodium Tri-α-naphthylboron in Diethyl Ether | journal=Journal of the American Chemical Society | publisher=American Chemical Society (ACS) | volume=57 | issue=10 | year=1935 | issn=0002-7863 | doi=10.1021/ja01313a051 | pages=1924–1927}}</ref> |
|||
=== 硼酸酯 === |
=== 硼酸酯 === |
||
三烷基硼烷,BR<sub>3</sub>可氧化为相应的[[硼酸]]的形式B(OR)<sub>3</sub>。鉴定化合物中具有的C-B键的数量,可通过R<sub>3</sub>B被[[三甲胺氧化物]](Me<sub>3</sub>NO)氧化成B(OR)<sub>3</sub>后,[[滴定]]形成的[[三甲胺]]的量来测算。 |
三烷基硼烷,BR<sub>3</sub>可氧化为相应的[[硼酸]]的形式B(OR)<sub>3</sub>。鉴定化合物中具有的C-B键的数量,可通过R<sub>3</sub>B被[[三甲胺氧化物]](Me<sub>3</sub>NO)氧化成B(OR)<sub>3</sub>后,[[滴定]]形成的[[三甲胺]]的量来测算。 |
||
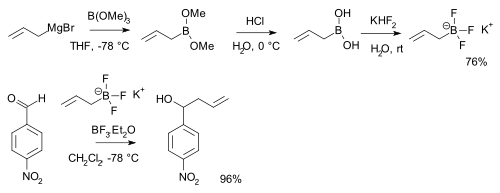
[[硼酸]]RB(OH)<sub>2</sub>与[[氟氢化钾]](K[HF<sub>2</sub>])反应,形成[[有机三氟硼酸|三氟硼酸盐]] K[RBF<sub>3</sub>] <ref name="vedejs" />, |
[[硼酸]]RB(OH)<sub>2</sub>与[[氟氢化钾]](K[HF<sub>2</sub>])反应,形成[[有机三氟硼酸|三氟硼酸盐]] K[RBF<sub>3</sub>] <ref name="vedejs" />,该物质是亲核性烷基或芳基二氟硼酸盐ArBF<sub>2</sub> 的前体<ref name="suzuki" />,该化合物盐的形式比起硼酸本身更稳定,因此常用于特定[[醛]]的烷基化反应。 |
||
[[硼酸]]RB(OH)<sub>2</sub>与[[氟氢化钾]]反应形成[[有机三氟硼酸酯|三氟硼酸盐]]K[RBF<sub>3</sub>]<ref name="vedejs" />,该物质是亲核性烷基或芳基二氟硼酸盐ArBF<sub>2</sub> 的前体<ref name="suzuki" />,该化合物盐的形式比起硼酸本身更稳定,因此常用于特定[[醛]]的烷基化反应。 |
|||
:<ref name="robert" />{{#tag:ref|图片为[[烯丙基溴化镁]]与[[三甲基硼酸酯]]反应,而后发生水解并用[[盐酸]]酸化后得到[[硼酸]]的过程。形成的硼酸与氟氢化钾形成三氟硼酸离子继而[[对硝基苯甲醛]]发生[[加成反应]]。|group=note}} |
:<ref name="robert" />{{#tag:ref|图片为[[烯丙基溴化镁]]与[[三甲基硼酸酯]]反应,而后发生水解并用[[盐酸]]酸化后得到[[硼酸]]的过程。形成的硼酸与氟氢化钾形成三氟硼酸离子继而[[对硝基苯甲醛]]发生[[加成反应]]。|group=note}} |
||
| 第66行: | 第66行: | ||
== 二硼烯烃 == |
== 二硼烯烃 == |
||
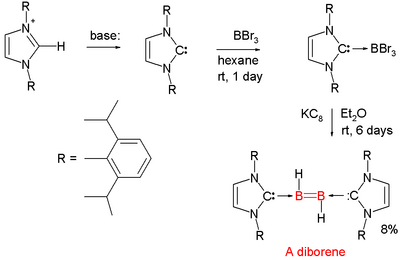
带有硼-硼[[双键]]的化合物相当罕见,直到2007年第一个中性的二硼烯烃化合物(RHB=BHR)才被发现<ref>''A Stable Neutral Diborene Containing a BdB Double Bond'' Yuzhong Wang, Brandon Quillian, Pingrong Wei, Chaitanya S. Wannere, Yaoming Xie, R. Bruce King, [[Henry F. Schaefer]], III, [[Paul v. R. Schleyer]], and Gregory H. Robinson {{DOI|10.1021/ja075932i}}</ref><ref>''Neutral Diborene Is A First'' Ron Dagani [[Chemical & Engineering News]] October 1, 2007 Volume 85, Number 40 p. 10 [http://pubs.acs.org/cen/news/85/i40/8540notw7.html]</ref><ref>反应的硼前体为[[三溴化硼]],还原剂为[[KC8]],它可以从[[乙醚]]溶剂当中提取质子。</ref> |
带有硼-硼[[双键]]的化合物相当罕见,直到2007年第一个中性的二硼烯烃化合物(RHB=BHR)才被发现<ref>''A Stable Neutral Diborene Containing a BdB Double Bond'' Yuzhong Wang, Brandon Quillian, Pingrong Wei, Chaitanya S. Wannere, Yaoming Xie, R. Bruce King, [[Henry F. Schaefer]], III, [[Paul v. R. Schleyer]], and Gregory H. Robinson {{DOI|10.1021/ja075932i}}</ref><ref>''Neutral Diborene Is A First'' Ron Dagani [[Chemical & Engineering News]] October 1, 2007 Volume 85, Number 40 p. 10 [http://pubs.acs.org/cen/news/85/i40/8540notw7.html] {{Wayback|url=http://pubs.acs.org/cen/news/85/i40/8540notw7.html |date=20081005152516 }}</ref><ref>反应的硼前体为[[三溴化硼]],还原剂为[[KC8]],它可以从[[乙醚]]溶剂当中提取质子。</ref> |
||
这种化合物的每个硼原子都连接了一个质子,且每个硼原子都和[[氮杂环卡宾]]<ref>也译作稳定卡宾</ref>配位。 |
这种化合物的每个硼原子都连接了一个质子,且每个硼原子都和[[氮杂环卡宾]]<ref>也译作稳定卡宾</ref>配位。 |
||
| 第84行: | 第84行: | ||
<ref name="carey">''Advanced Organic Chemistry'', F.A. carey, R.J. Sundberg ISBN 0-306-41088-5</ref> |
<ref name="carey">''Advanced Organic Chemistry'', F.A. carey, R.J. Sundberg ISBN 0-306-41088-5</ref> |
||
<ref name="lachance">Lachance, H.; Hall, D. ''[[Org. React.]]'' '''2008''', ''73'', 1. (doi: [http://dx.doi.org/10.1002/0471264180.or073.01 10.1002/0471264180.or073.01])</ref> |
<ref name="lachance">Lachance, H.; Hall, D. ''[[Org. React.]]'' '''2008''', ''73'', 1. (doi: [http://dx.doi.org/10.1002/0471264180.or073.01 10.1002/0471264180.or073.01])</ref> |
||
<ref name="Nicolaou1998">{{cite journal | author = Nicolaou, K.C. | coauthors = Sarabia, F.; Ninkovic, S.; Finlay, M.R.V.; Boddy, C.N.C. | year = 1998 | title = Probing The Ring Size Of Epothilones: Total Synthesis Of 14-, 15-, 17-, And 18 Epothilones A | journal = Angewandte Chemie. International edition in English | volume = 37 | issue = 1–2 | pages = 81–84 | url = http://cat.inist.fr/?aModele=afficheN&cpsidt=10349604 |
<ref name="Nicolaou1998">{{cite journal | author = Nicolaou, K.C. | coauthors = Sarabia, F.; Ninkovic, S.; Finlay, M.R.V.; Boddy, C.N.C. | year = 1998 | title = Probing The Ring Size Of Epothilones: Total Synthesis Of 14-, 15-, 17-, And 18 Epothilones A | journal = Angewandte Chemie. International edition in English | volume = 37 | issue = 1–2 | pages = 81–84 | url = http://cat.inist.fr/?aModele=afficheN&cpsidt=10349604 | accessdate = 2008-03-02 | archive-date = 2012-03-14 | archive-url = https://web.archive.org/web/20120314061308/http://cat.inist.fr/?aModele=afficheN&cpsidt=10349604 | dead-url = no }}</ref> |
||
<ref name="vedejs">''Conversion of Arylboronic Acids into Potassium Aryltrifluoroborates: Convenient Precursors of Arylboron Difluoride Lewis Acids '' E. Vedejs, R. W. Chapman, S. C. Fields, S. Lin, M. R. Schrimpf [[J. Org. Chem.]] '''1995'''; 60(10); 3020–3027. {{DOI|10.1021/jo00115a016}}</ref> |
<ref name="vedejs">''Conversion of Arylboronic Acids into Potassium Aryltrifluoroborates: Convenient Precursors of Arylboron Difluoride Lewis Acids '' E. Vedejs, R. W. Chapman, S. C. Fields, S. Lin, M. R. Schrimpf [[J. Org. Chem.]] '''1995'''; 60(10); 3020–3027. {{DOI|10.1021/jo00115a016}}</ref> |
||
<ref name="suzuki">''Organotrifluoroborates and Monocoordinated Palladium Complexes as Catalysts—A Perfect Combination for Suzuki–Miyaura Coupling'' Gary A. Molander and Belgin Canturk [[Angew. Chem. Int. Ed.]] '''2009''', 48, 9240 – 9261{{DOI|10.1002/anie.200904306}}</ref> |
<ref name="suzuki">''Organotrifluoroborates and Monocoordinated Palladium Complexes as Catalysts—A Perfect Combination for Suzuki–Miyaura Coupling'' Gary A. Molander and Belgin Canturk [[Angew. Chem. Int. Ed.]] '''2009''', 48, 9240 – 9261{{DOI|10.1002/anie.200904306}}</ref> |
||
<ref name="robert">Organoboron compounds as mild nucleophiles in Lewis acid- and transition metal-catalyzed |
<ref name="robert">Organoboron compounds as mild nucleophiles in Lewis acid- and transition metal-catalyzed |
||
C–C bond-forming reactions Robert A. Batey, Tan D. Quach, Ming Shen, Avinash N. Thadani, David V. Smil, Sze-Wan Li, and D. Bruce MacKay Pure Appl. Chem., Vol. 74, No. 1, pp. 43–55, '''2002'''. http://www.iupac.org/publications/pac/2002/pdf/7401x0043.pdf</ref> |
C–C bond-forming reactions Robert A. Batey, Tan D. Quach, Ming Shen, Avinash N. Thadani, David V. Smil, Sze-Wan Li, and D. Bruce MacKay Pure Appl. Chem., Vol. 74, No. 1, pp. 43–55, '''2002'''. http://www.iupac.org/publications/pac/2002/pdf/7401x0043.pdf {{Wayback|url=http://www.iupac.org/publications/pac/2002/pdf/7401x0043.pdf |date=20120224225055 }}</ref> |
||
<ref name="yasutomo">''Boryllithium: Isolation, Characterization, and Reactivity as a Boryl Anion'' Yasutomo Segawa, Makoto Yamashita, [[Kyoko Nozaki]] [[Science (journal)|Science]] 6 October 2006: |
<ref name="yasutomo">''Boryllithium: Isolation, Characterization, and Reactivity as a Boryl Anion'' Yasutomo Segawa, Makoto Yamashita, [[Kyoko Nozaki]] [[Science (journal)|Science]] 6 October 2006: |
||
Vol. 314. no. 5796, pp. 113 – 115 {{DOI|10.1126/science.1131914}}</ref> |
Vol. 314. no. 5796, pp. 113 – 115 {{DOI|10.1126/science.1131914}}</ref> |
||
<ref name="bethany">''Boron Attacks Electropositive element pressed into action as nucleophilic boryllithium'' Bethany Halford [[Chemical & Engineering News]] October 9, 2006 Volume 84, Number 41 p. 11 [http://pubs.acs.org/cen/news/84/i41/8441notw8.html Link]</ref> |
<ref name="bethany">''Boron Attacks Electropositive element pressed into action as nucleophilic boryllithium'' Bethany Halford [[Chemical & Engineering News]] October 9, 2006 Volume 84, Number 41 p. 11 [http://pubs.acs.org/cen/news/84/i41/8441notw8.html Link] {{Wayback|url=http://pubs.acs.org/cen/news/84/i41/8441notw8.html |date=20081004231326 }}</ref> |
||
<ref name="dennis">''Boronic Acids: Preparation, Applications in Organic Synthesis and Medicine''. Dennis G. Hall ISBN 3-527-30991-8</ref> |
<ref name="dennis">''Boronic Acids: Preparation, Applications in Organic Synthesis and Medicine''. Dennis G. Hall ISBN 3-527-30991-8</ref> |
||
<ref name="peter">''Reactions at the Boron-Carbon Double Bond of Methyl(methylidene)boranes'' |
<ref name="peter">''Reactions at the Boron-Carbon Double Bond of Methyl(methylidene)boranes'' |
||
2023年11月12日 (日) 11:15的最新版本

有机硼或有机硼化合物是一类硼烷BH3的有机衍生物,如:三烷基硼烷。有机硼化学或有机硼烷化学是研究这类化合物的化学。[1][2] 在有机化学中,有机硼化合物因其多种变化而被广泛应用,其中如常用的还原反应:硼氢化反应。
理化性质
[编辑]碳-硼键属低极性化学键(其元素电负性差别:碳2.55;硼2.04),因此烷基硼化合物虽大多易于氧化但性质较稳定。乙烯基和芳基连于硼原子上,会提供电子给硼原子使得其具有更小的电负性,并让碳-硼键具有一定的双键特性。有机硼烷类似于其母体乙硼烷的性质,属于有机化学中较强的亲电试剂,这是由于硼原子无法得到八隅体的的全部电子。不同于乙硼烷的是,有机硼烷化合物不形成二聚体。
其他有趣的硼烷,例如碳硼烷化合物,属于碳、硼与硼代苯的原子簇化合物,其硼和苯为等当量。环状化合物硼咯,是一种吡咯的结构类似物 ,至今无法分离,但其取代衍生物已经被发现。
有机硼烷化合物的氧原子可被取代,得到二烃基硼酸酯R2BOR、单烃基硼酸酯RB(OR)2或硼酸酯B(OR)3,如:三甲基硼酸酯。在有机金属化学中,带有硼-金属键的化合物统称为:硼基(M–BR2)或亚硼基(M–B(R)–M)。
合成
[编辑]从格氏反应合成
[编辑]简单的有机硼烷,如:三乙基硼烷或三(全氟苯基)硼烷可通过三氟化硼(通常为乙醚的络合物)来制备,或通过乙基或全氟苯基硼烷与格氏试剂反应制备。
从烯烃合成
[编辑]硼烷与烯烃可迅速发生反应,称为:硼氢化反应。这个概念由赫伯特·布朗在普渡大学发现,并由此获得了诺贝尔奖(与发现维蒂希反应的化学家格奥尔格·维蒂希共同获得)。乙硼烷通常以二聚体存在,而BH3单体可与碱性溶剂,如四氢呋喃形成1:1的络合物。在简单的HX(X = Cl,Br,I等)参与的亲电加成反应中均符合马氏规则,即:最小电负性的原子(通常为氢原子),加成至双键上最少取代基的一侧,这决定了区域选择性。硼对于双键的亲电加成同样如此,由于硼元素的电负性较氢元素更弱,氢原子总是加成于取代最多的碳原子上。烯烃上形成的正电荷在取代基最多的碳原子上,部分负电荷的氢原子与之加成,留下的硼原子加成于取代基更少的碳原子上。上述的这种加成方式,称为“反马氏规则”,当硼原子被羟基取代后,水对于双键的加成就是符合反马氏规则。
当硼化合物带有大位阻取代基时,其化学性质很特别。如一种有机硼化合物常用于有机合成:9-BBN。该化合物可通过环辛二烯与乙硼烷反应制备。[3] 在顺式硼氢化过程中会发生立体专一性,即在烯烃的同一面进行加成反应。在该协同反应中,过渡态表示为一种被由碳原子、氢原子与硼原子组成的正方形。在此正方形中,在两个双键、p-轨道和硼原子的空轨道的之间具有最大电子云重叠。
反应
[编辑]硼氢化氧化
[编辑]在有机合成中,硼氢化反应常用于通过引入硼基团而继续转化为其他官能团。硼氢化-氧化反应通过先与硼烷加成,后使用过氧化氢氧化提供了一种合成醇的方法。该反应过程中,若将氧化剂替换成氧化铬,将使得羟基继续氧化成羰基化合物。
重排反应
[编辑]有机硼化合物可参与引入新的碳-碳键的化学反应。一氧化碳被发现易与三烷基硼烷发生反应。当负电性的硼原子上有烷基取代基时可发生1,2-重排反应,该烷基可重排至临近的亲电性的羰基碳原子上。而羰基可进一步还原为羟基。
烯丙基硼烷化
[编辑]烯丙位不对称硼化展示了有机硼化合物在碳-碳键形成反应中的另一个应用实例。[4] 在Nicolaou合成了埃博霉素[5]的例子中,使用了手性α-蒎烯衍生出的不对称烯丙基硼化反应,该反应用于连接TBS保护基(叔丁基二甲基硅烷)并继而发生臭氧分解反应。
金属转移反应
[编辑]有机硼化合物还可与有机钯化合物发生金属转移反应。该反应类型在铃木反应中被广泛应用。
参与氧化还原反应
[编辑]混合硼烷,如9-BBN和三仲丁基硼氢化锂(L-selectride)属于一类还原剂。例如羰基还原反应中的不对称催化剂就是CBS催化剂。该催化剂属有机硼催化剂,用于反应中与羰基氧原子配位。
三苯基硼或三(α-萘基)硼和钠汞齐反应,可以得到Na[BPh3]或Na2[BNp3](Np=萘基)。[6][7]
硼酸酯
[编辑]三烷基硼烷,BR3可氧化为相应的硼酸的形式B(OR)3。鉴定化合物中具有的C-B键的数量,可通过R3B被三甲胺氧化物(Me3NO)氧化成B(OR)3后,滴定形成的三甲胺的量来测算。
硼酸RB(OH)2与氟氢化钾(K[HF2])反应,形成三氟硼酸盐 K[RBF3] [8],该物质是亲核性烷基或芳基二氟硼酸盐ArBF2 的前体[9],该化合物盐的形式比起硼酸本身更稳定,因此常用于特定醛的烷基化反应。
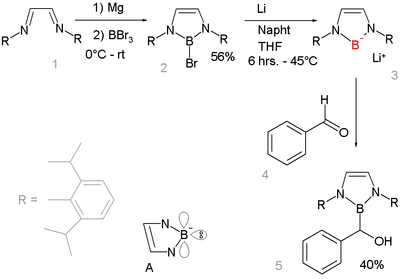
硼基锂
[编辑]亲核性的硼基负离子化合物长久以来未受重视,从2006年以来研究发现了一种硼基锂化合物,可作为很强的亲核试剂[11][12]:
这个发现非常重要,因为其他的第二周期元素组成的锂化合物较常见,如:氟化锂,氢氧化锂,氨基锂以及其他的有机锂化合物。碱和硼氢化合物 R2B反应不会导致去质子化形成硼基负离子R2B-,而是形成硼基负离子R2B-H(base)+,这是因为反应过程中不能形成完整的八隅体。[13]
亚烷基硼
[编辑]亚烷基硼具有RB=CRR的形态:一个硼原子与一个碳原子组成双键,是一种少见的化合物类型,如硼苯。其母体化合物为HB=CH2,可在低温下检测到。还有一种很稳定的衍生物为:CH3B=C(SiMe3)2,但非常容易发生环二聚反应。[14]
二硼烯烃
[编辑]带有硼-硼双键的化合物相当罕见,直到2007年第一个中性的二硼烯烃化合物(RHB=BHR)才被发现[15][16][17] 这种化合物的每个硼原子都连接了一个质子,且每个硼原子都和氮杂环卡宾[18]配位。
注释
[编辑]参见
[编辑]- 在元素周期表中碳元素与其他元素组成的化合物
参考文献
[编辑]- ^ The Roles of Boron and Silicon, Susan E. Thomas; Oxford Chemistry Primers No.1; 1991: Very good general book covering all the important reactions of boron and organoboranes in organic chemistry.
- ^ Organometallics Christoph Elschenbroich 3rd Ed. 2006 ISBN 3-527-29390-6 – Wiley-VCH, Weinheim
- ^ Advanced Organic Chemistry, F.A. carey, R.J. Sundberg ISBN 0-306-41088-5
- ^ Lachance, H.; Hall, D. Org. React. 2008, 73, 1. (doi: 10.1002/0471264180.or073.01)
- ^ Nicolaou, K.C.; Sarabia, F.; Ninkovic, S.; Finlay, M.R.V.; Boddy, C.N.C. Probing The Ring Size Of Epothilones: Total Synthesis Of 14-, 15-, 17-, And 18 Epothilones A. Angewandte Chemie. International edition in English. 1998, 37 (1–2): 81–84 [2008-03-02]. (原始内容存档于2012-03-14).
- ^ Bent, Henry E.; Dorfman, Maurice. PENTAVALENT BORON. Journal of the American Chemical Society (American Chemical Society (ACS)). 1932, 54 (5): 2132–2133. ISSN 0002-7863. doi:10.1021/ja01344a511.
- ^ Bent, Henry E.; Dorfman, Maurice. The Conductance of Non-aqueous Solutions. I. Sodium Triphenylboron and Disodium Tri-α-naphthylboron in Diethyl Ether. Journal of the American Chemical Society (American Chemical Society (ACS)). 1935, 57 (10): 1924–1927. ISSN 0002-7863. doi:10.1021/ja01313a051.
- ^ Conversion of Arylboronic Acids into Potassium Aryltrifluoroborates: Convenient Precursors of Arylboron Difluoride Lewis Acids E. Vedejs, R. W. Chapman, S. C. Fields, S. Lin, M. R. Schrimpf J. Org. Chem. 1995; 60(10); 3020–3027. doi:10.1021/jo00115a016
- ^ Organotrifluoroborates and Monocoordinated Palladium Complexes as Catalysts—A Perfect Combination for Suzuki–Miyaura Coupling Gary A. Molander and Belgin Canturk Angew. Chem. Int. Ed. 2009, 48, 9240 – 9261doi:10.1002/anie.200904306
- ^ Organoboron compounds as mild nucleophiles in Lewis acid- and transition metal-catalyzed C–C bond-forming reactions Robert A. Batey, Tan D. Quach, Ming Shen, Avinash N. Thadani, David V. Smil, Sze-Wan Li, and D. Bruce MacKay Pure Appl. Chem., Vol. 74, No. 1, pp. 43–55, 2002. http://www.iupac.org/publications/pac/2002/pdf/7401x0043.pdf (页面存档备份,存于互联网档案馆)
- ^ Boryllithium: Isolation, Characterization, and Reactivity as a Boryl Anion Yasutomo Segawa, Makoto Yamashita, Kyoko Nozaki Science 6 October 2006: Vol. 314. no. 5796, pp. 113 – 115 doi:10.1126/science.1131914
- ^ Boron Attacks Electropositive element pressed into action as nucleophilic boryllithium Bethany Halford Chemical & Engineering News October 9, 2006 Volume 84, Number 41 p. 11 Link (页面存档备份,存于互联网档案馆)
- ^ Boronic Acids: Preparation, Applications in Organic Synthesis and Medicine. Dennis G. Hall ISBN 3-527-30991-8
- ^ Reactions at the Boron-Carbon Double Bond of Methyl(methylidene)boranes Peter Paetzold, Ulli Englert, Rudolf Finger, Thomas Schmitz, Alexander Tapper, and Ralf Ziembinski Z. Anorg. Allg. Chem. 2004, 630, 508–518 doi:10.1002/zaac.200300396
- ^ A Stable Neutral Diborene Containing a BdB Double Bond Yuzhong Wang, Brandon Quillian, Pingrong Wei, Chaitanya S. Wannere, Yaoming Xie, R. Bruce King, Henry F. Schaefer, III, Paul v. R. Schleyer, and Gregory H. Robinson doi:10.1021/ja075932i
- ^ Neutral Diborene Is A First Ron Dagani Chemical & Engineering News October 1, 2007 Volume 85, Number 40 p. 10 [1] (页面存档备份,存于互联网档案馆)
- ^ 反应的硼前体为三溴化硼,还原剂为KC8,它可以从乙醚溶剂当中提取质子。
- ^ 也译作稳定卡宾