置换反应:修订间差异
外观
删除的内容 添加的内容
| (未显示13个用户的16个中间版本) | |||
| 第1行: | 第1行: | ||
{{unreferenced|time=2014-06-07T09:59:06+00:00}} |
|||
{{portal|化學|Nuvola apps edu science.svg}} |
{{portal|化學|Nuvola apps edu science.svg}} |
||
'''置換反應'''又稱'''單置換反應''',是指一種[[元素]]或[[化合物]]的離子根與一種[[離子化合物]]發生的反應,[[氧化還原反應]]是置換反應的一種。在反應中,關鍵在於[[還原性]]或[[氧化性]]的強弱,[[還原性]]或[[氧化性]]強的物質與相對較弱的物質進行置換。置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应。 |
'''置換反應'''又稱'''單置換反應''',是指一種[[元素]]或[[化合物]]的離子根與一種[[離子化合物]]發生的反應,狹義[[氧化還原反應]]是置換反應的一種,且必為廣義的氧化還原反應。在反應中,關鍵在於[[還原性]]或[[氧化性]]的強弱,[[還原性]]或[[氧化性]]強的物質與相對較弱的物質進行置換。置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应。 |
||
:<chem>A + BC -> AC + B</chem> |
|||
這就是反應的通式,其中: |
|||
: A 和 B 代表不同[[金屬]](或[[氫]]等可以產生[[陽離子]]的[[元素]]),而 C 為[[陰離子]]; |
|||
:: ''或'' |
|||
: A 和 B 代表[[鹵素]],而 C 是陽離子<ref>{{Cite web|last=|first=|date=2016-06-27|title=Single Replacement Reactions|url=https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Book%3A_Introductory_Chemistry_(CK-12)/11%3A_Chemical_Reactions/11.07%3A_Single_Replacement_Reactions|url-status=no|archive-url=https://web.archive.org/web/20211206152843/https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Book:_Introductory_Chemistry_(CK-12)/11:_Chemical_Reactions/11.07:_Single_Replacement_Reactions|archive-date=2021-12-06|access-date=|website=Chemistry LibreTexts|language=en}}</ref>。 |
|||
<br /> |
<br /> |
||
[[file:Single displacement reaction example.png|center|一个简单的置换反应例子]] |
[[file:Single displacement reaction example.png|center|一个简单的置换反应例子]] |
||
| 第9行: | 第14行: | ||
<br /> |
<br /> |
||
上面是一个置换反应的例子,反应前后各元素[[氧化態]]可能改变。<br /> |
上面是一个置换反应的例子,反应前后各元素[[氧化態]]可能改变。<br /> |
||
在置換反應中,只會有[[正離子]]或[[負離子]]的其中一方進行置換,沒有進行反應的離子為'''[[旁觀離子]]'''。上面的例子中[[硫酸根]]為'''[[旁觀離子]]'''。 |
在置換反應中,只會有[[正離子]]或[[离子#阴离子|負離子]]的其中一方進行置換,沒有進行反應的離子為'''[[旁觀離子]]'''。上面的例子中[[硫酸根]]為'''[[旁觀離子]]'''。 |
||
==反应式== |
==反应式== |
||
| 第23行: | 第28行: | ||
==置換條件== |
==置換條件== |
||
發生反應的條件主要是看金屬的[[活性序]],且一定發生在水中([[氧化還原反應]]不一定)。活性序排在前面的金屬可以與排在後面的金屬置換,因為排在愈前面的金屬愈容易失去[[電子]]。當[[水溶液]]中的[[離子化合物]]不止一種時,則會先和活性序較後面的金屬離子反應,如果活性序是排在能與[[水]]直接反應的金屬,則包括水分子中的[[氫]]離子在內。 |
發生反應的條件主要是看金屬的[[活性序]],且一定發生在水中(狹義[[氧化還原反應]]不一定)。活性序排在前面的金屬可以與排在後面的金屬置換,因為排在愈前面的金屬愈容易失去[[電子]]。當[[水溶液]]中的[[離子化合物]]不止一種時,則會先和活性序較後面的金屬離子反應,如果活性序是排在能與[[水]]直接反應的金屬,則包括水分子中的[[氫]]離子在內。 |
||
以下是金屬活動性順序簡表: |
|||
K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au。 |
|||
其中10號氫是過渡元素,它前面的可以置換出氫(有例外),它後面的則不行。 也就是說:氫前面的可以和酸反應生成氫氣,而氫後面的基本不和酸反應,就算反應也不生成氫氣。 |
|||
| ⚫ | |||
| ⚫ | |||
<chem>C + H2O</chem><math>\overset{\bigtriangleup}{==}</math><chem>CO ^ + H2 ^</chem> |
|||
| ⚫ | |||
| ⚫ | |||
<chem>2Mg + CO2</chem><math>\overset{\bigtriangleup}{==}</math><chem>2MgO + C</chem> |
|||
C + H<sub>2</sub>O =△= CO↑ + H<sub>2</sub> |
|||
<chem>3Fe + 4H2O =Fe3O4 + 4H2 ^</chem>(加熱會使反應加速) |
|||
2Mg + CO<sub>2</sub> =△= 2MgO + C |
|||
| ⚫ | |||
2Fe + 3H<sub>2</sub>O → Fe<sub>2</sub>O<sub>3</sub> + 3H<sub>2</sub> (加熱會使反應加速) |
|||
==參考資料== |
|||
| ⚫ | |||
{{reflist}} |
|||
==参见== |
==参见== |
||
2024年5月9日 (四) 07:45的最新版本
置換反應又稱單置換反應,是指一種元素或化合物的離子根與一種離子化合物發生的反應,狹義氧化還原反應是置換反應的一種,且必為廣義的氧化還原反應。在反應中,關鍵在於還原性或氧化性的強弱,還原性或氧化性強的物質與相對較弱的物質進行置換。置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应。
這就是反應的通式,其中:
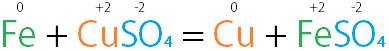
上面是一个置换反应的例子,反应前后各元素氧化態可能改变。
在置換反應中,只會有正離子或負離子的其中一方進行置換,沒有進行反應的離子為旁觀離子。上面的例子中硫酸根為旁觀離子。
反应式
[编辑]在置換反應中,一般可以有兩種化學式,一種是標準的化學方程式,另一種是離子化學式(半化學式)。
基於旁觀離子並沒有進行化學反應,因此在化學方程式中省略旁觀離子的部份,並得出離子化學式。因此,離子化學式的左右兩方也帶有相同的電荷。
例子
[编辑]假使A和B的離子電荷為2+,X為2-。
- 化學式:
- 實例:
- 離子化學式:
- 實例:
置換條件
[编辑]發生反應的條件主要是看金屬的活性序,且一定發生在水中(狹義氧化還原反應不一定)。活性序排在前面的金屬可以與排在後面的金屬置換,因為排在愈前面的金屬愈容易失去電子。當水溶液中的離子化合物不止一種時,則會先和活性序較後面的金屬離子反應,如果活性序是排在能與水直接反應的金屬,則包括水分子中的氫離子在內。
以下是金屬活動性順序簡表: K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au。 其中10號氫是過渡元素,它前面的可以置換出氫(有例外),它後面的則不行。 也就是說:氫前面的可以和酸反應生成氫氣,而氫後面的基本不和酸反應,就算反應也不生成氫氣。
狹義氧化還原與置換反應的比較
[编辑]
(加熱會使反應加速)
上面為狹義氧化還原反應的例子
參考資料
[编辑]- ^ Single Replacement Reactions. Chemistry LibreTexts. 2016-06-27. (原始内容存档于2021-12-06) (英语).











