三枝-伊藤氧化反应:修订间差异
Mouse20080706(留言 | 贡献) GA |
Add 1 book for verifiability (20241007)) #IABot (v2.0.9.5) (GreenC bot |
||
| (未显示13个用户的37个中间版本) | |||
| 第1行: | 第1行: | ||
{{noteTA |
|||
{{Good article}} |
|||
|1=zh-cn:烯醇硅醚; zh-tw:烯醇矽醚; zh-hk:烯醇矽醚; |
|||
| ⚫ | ''' |
||
|2=zh-cn:通过; zh-tw:透過; zh-hk:通過; |
|||
|3=zh-cn:三甲基氯硅烷; zh-tw:三甲基氯矽烷; zh-hk:三甲基氯矽烷; |
|||
|4=zh-cn:官能团;zh-tw:官能基; |
|||
}} |
|||
| ⚫ | '''三枝–伊藤氧化反应'''({{lang-en|Saegusa–Ito oxidation}})是[[有机化学]]中一个将[[碳-碳键|碳-碳单键]]转变为[[烯烃|碳-碳双键]]的[[化学反应|反应]]。这个在[[羰基#羰基化合物|羰基化合物]]中引入α,β-不饱和结构的方法是由[[京都大学]]的[[三枝武夫]]和[[伊藤嘉彦]]在1978年发现的<ref name="Saegusa">{{cite|author=Ito,Yoshihiko; Hirao,Toshikazu; Saegusa,Takeo|journal=[[有机化学期刊|Journal of Organic Chemistry]]|title=Synthesis of .alpha.,.beta.-unsaturated carbonyl compounds by palladium(II)-catalyzed dehydrosilylation of silyl enol ethers|year=1978|volume=43|issue=5|pages=1011–1013|doi=10.1021/jo00399a052}}</ref>。最初报道的方法是先将酮转化为相应的烯醇硅醚,接着将[[烯醇硅醚]]与[[醋酸钯]]和[[对苯醌]]反应从而产生[[α,β-不饱和羰基化合物]]。最早的原始文献指出可利用产物中新形成的不饱和双键,通过亲核试剂(比如有机铜试剂)对其进行[[麦克尔加成反应|1,4-加成反应]]以达到进一步衍生化的目的。 |
||
[[File:SaegusaOxidationIntro. |
[[File:SaegusaOxidationIntro.svg|center|500px|三枝–伊藤氧化反应]] |
||
对于非环状底物,反应只会得到热力学产物反式烯酮。 |
对于非环状底物,反应只会得到热力学产物反式烯酮。 |
||
[[File: |
[[File:Saegusa_Acyclic.svg|center|500px|非环状底物]] |
||
实际上在三枝武夫和伊藤嘉彦发表这一发现的八年之前,就已有一篇文献报道称可用未活化的[[酮]]和醋酸钯反应亦能得到相同的产物,但产率较低<ref name="Theissen">{{cite|author=Theissen, R. J.|journal=Journal of Organic Chemistry|year=1971|volume=36|pages=752|doi=10.1021/jo00805a004|title=Preparation of .alpha.,.beta.-unsaturated carbonyl compunds}}</ref>。三枝和伊藤为此对这一反应所做的重大改进就是明确了[[烯醇]]式是反应的活性物种,并由此开发出了这种基于烯醇硅醚的方法。通过先将醛或酮用强碱性的[[氨基锂|2,2,6,6-四甲基哌啶锂]]或[[二异丙基氨基锂]]处理,发生[[去质子化]]生成烯醇负离子[[中间体]],后加入[[三甲基氯硅烷]]捕获负离子中间体的方法可以方便地合成 |
实际上在三枝武夫和伊藤嘉彦发表这一发现的八年之前,就已有一篇文献报道称可用未活化的[[酮]]和醋酸钯反应亦能得到相同的产物,但产率较低<ref name="Theissen">{{cite|author=Theissen, R. J.|journal=Journal of Organic Chemistry|year=1971|volume=36|pages=752|doi=10.1021/jo00805a004|title=Preparation of .alpha.,.beta.-unsaturated carbonyl compunds}}</ref>。三枝和伊藤为此对这一反应所做的重大改进就是明确了[[烯醇]]式是反应的活性物种,并由此开发出了这种基于烯醇硅醚的方法。通过先将醛或酮用强碱性的[[氨基锂|2,2,6,6-四甲基哌啶锂]]或[[二异丙基氨基锂]]处理,发生[[去质子化]]生成烯醇负离子[[中间体]],后加入[[三甲基氯硅烷]]捕获负离子中间体的方法可以方便地合成三枝氧化所用的原料烯醇硅醚。由于这个烯醇硅醚合成方法的副产物仅为[[氯化锂]]和胺,它们对后续的氧化反应没有较大影响并且烯醇硅醚容易[[水解]],所以用这个方法合成出的烯醇硅醚可不经分离纯化直接用于接下来的三枝氧化反应<ref>{{cite journal|author=Brownbridge, P.|title=Silyl Enol Ethers in Synthesis - Part I|journal=Synthesis|year=1983|page=1-28|doi=10.1055/s-1983-30204}}</ref><ref>{{cite journal|author=Brownbridge, P.|title=Silyl Enol Ethers in Synthesis - Part II|journal=Synthesis|year=1983|pages=85-104|doi=10.1055/s-1983-30234}}</ref>。 |
||
反应通常采用 |
反应通常采用非催化量的钯,故一般对于工业生产来说成本过高,不过人们已在[[催化剂]]变体的开发上已经取得了一些进展。虽然该方法存在缺点,但三枝氧化反应依然是一个温和的合成方法,可用于在合成路线的尾端向具有多种[[官能团]]的复杂分子中引入新的官能团。 |
||
== 反应机理 == |
== 反应机理 == |
||
三枝–伊藤氧化反应的 |
三枝–伊藤氧化反应的机理如下:首先是二价钯与烯醇硅醚双键的[[配合物|配位]],随后三甲基硅基与醋酸根形成[[三甲基硅基醋酸酯]]离去,同时形成烯醇钯物种,接着发生[[消除反应|β-氢消除]]得到钯氢物种的烯酮[[配合物|络合物]],最后钯氢物种发生还原消除得到产物同时生成醋酸和零价钯<ref name="Myers">[http://www.chem.harvard.edu/groups/myers/handouts/2_Oxidation.pdf Oxidation] {{Wayback|url=http://www.chem.harvard.edu/groups/myers/handouts/2_Oxidation.pdf |date=20110312063732 }}, Chem 215 lecture notes</ref>。β-氢消除步骤是一个存在[[化学平衡]]的可逆反应,所以对于非环状的底物,反应会选择性地生成反式双键构型的热力学产物。有证据显示零价钯会与反应产物形成类似[[三(二亚苄基丙酮)二钯|Pd<sub>2</sub>(dba)<sub>3</sub>]]的配合物,使得零价钯很难被氧化再生。<ref name="Porth">{{cite|author=Porth, S.; Bats, J. W.; Trauner, D.; Giester, G.; Mulzer, J.|title=Insight into the Mechanism of the Saegusa Oxidation: Isolation of a Novel Palladium(0)–Tetraolefin Complex|url=http://onlinelibrary.wiley.com/doi/10.1002/(SICI)1521-3773(19990712)38:13/14%3C2015::AID-ANIE2015%3E3.0.CO;2-%23/abstract|journal=[[应用化学 (期刊)|Angewandte Chemie International Edition]]|year=1999|volume=38|pages=2015|doi=10.1002/(sici)1521-3773(19990712)38:13/14<2015::aid-anie2015>3.0.co;2-#}}</ref><ref>{{cite journal|author=Toyota, M.; Ihara, M|title=Development of Palladium-catalyzed cycloalkenylation and its application to natural product synthesis.|journal=Synlett|year=2000|issue=8|pages=1211-1222|doi=10.1055/s-2002-32946|url=https://www.thieme-connect.com/ejournals/abstract/10.1055/s-2002-32946}}</ref> |
||
[[File:SaegusaMechanism.png|center|500px|三枝氧化的机理]] |
|||
以[[对苯醌]]为氧化剂可将零价的钯氧化使二价钯再生: |
以[[对苯醌]]为氧化剂可将零价的钯氧化使二价钯再生: |
||
| 第21行: | 第26行: | ||
:<math>\rm \ Pd(0) \ + \ 2 HOAc \ + \ </math> [[对苯醌]] <math>\rm \ \rightarrow</math> [[对苯二酚]] <math>\rm \ + \ Pd(OAc)_2</math> |
:<math>\rm \ Pd(0) \ + \ 2 HOAc \ + \ </math> [[对苯醌]] <math>\rm \ \rightarrow</math> [[对苯二酚]] <math>\rm \ + \ Pd(OAc)_2</math> |
||
也能以[[氧气]]为氧化剂使二价钯再生:<ref>{{cite book|author=Laszlo Kurti, Barbara Czako|title=Strategic Applications of Named Reactions in Organic Synthesis|year=2005|url=https://archive.org/details/strategicapplica0000kurt|pages=[https://archive.org/details/strategicapplica0000kurt/page/390 390]-391|ISBN=0124297854}}</ref> |
|||
也能以[[氧气]]为氧化剂使二价钯再生: |
|||
:<math>\rm \ Pd(0) \ + \ O_2 \ \rightarrow \ Pd(II)(\!-\!O\!-\!)_2 \ \xrightarrow {HOAc} \ AcO\!-\!Pd(II)\!-\!O\!-\!OH \ \xrightarrow {Me_3SiOAc} \ Pd(OAc)_2</math> (重新进入循环) <math>\rm \ + \ HOOSiMe_3</math> |
:<math>\rm \ Pd(0) \ + \ O_2 \ \rightarrow \ Pd(II)(\!-\!O\!-\!)_2 \ \xrightarrow {HOAc} \ AcO\!-\!Pd(II)\!-\!O\!-\!OH \ \xrightarrow {Me_3SiOAc} \ Pd(OAc)_2</math> (重新进入循环) <math>\rm \ + \ HOOSiMe_3</math> |
||
== 应用 == |
== 应用 == |
||
从[[环己烯酮]]的衍生物通过两步反应制取一个二烯酮产物<ref>{{cite journal en|title=Formation of Benzo-Fused Carbocycles by Formal Radical Cyclization onto an Aromatic Ring|author=Derrick L. J. Clive and Rajesh Sunasee|journal=[[Org. Lett.]]|year=2007|volume=9|issue=14|pages=2677–2680|doi=10.1021/ol070849l}}</ref> |
从[[环己烯酮]]的衍生物通过两步反应制取一个二烯酮产物<ref>{{cite journal en|title=Formation of Benzo-Fused Carbocycles by Formal Radical Cyclization onto an Aromatic Ring|author=Derrick L. J. Clive and Rajesh Sunasee|journal=[[Org. Lett.]]|year=2007|volume=9|issue=14|pages=2677–2680|doi=10.1021/ol070849l}}</ref>: |
||
<br /> |
<br /> |
||
[[File:SaegusaApplication.png|400px|center| |
[[File:SaegusaApplication.png|400px|center|三枝化反应的应用 Clive 2007]] |
||
{{#tag:ref|第一步中试剂为[[三氟甲磺酸三甲基硅酯]]和[[2,6-二甲基吡啶]]|group=注}} |
|||
Saegusa-Ito氧化反应具有广泛适用性,使得它可用于多个天然化合物分子的[[全合成]]中,下面的几个例子就能很好的体现出这一特点。 |
|||
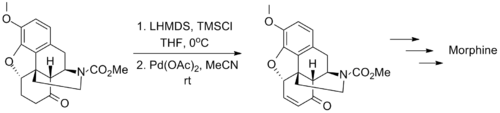
2006年[[福山透]]运用这个方法完成了对[[吗啡]]的全合成,这个氧化方法能兼容分子中的[[氨基甲酸酯]]和[[烯丙基]][[醚]]结构<ref name="Uchida">{{cite journal|author=Uchida, K.; Yokoshima, S.; Kan, T.; Fukuyama, T.|journal=[[Organic Letters]]|year=2006|volume=8|pages=5311|title=Total Synthesis of (±)-Morphine|doi=10.1021/ol062112m}}</ref>。 |
三枝-伊藤氧化反应是在羰基旁边引入碳-碳双键的有效手段,常被用于天然化合物分子的[[全合成]]中。<ref>{{cite|title=Synthesis of a,b-unsaturated carbonyl compounds via a visible-light-promoted organocatalytic aerobic oxidation|url=http://web.pkusz.edu.cn/huang/files/2013/04/Synthesis-of-%CE%B1%CE%B2-unsaturated-carbonyl-compounds-via-a-visible-light-promoted-organocatalytic-aerobic-oxidation.pdf|author=Junlin Zhang, Leming Wang, Qi Liu, Zhen Yang and Yong Huang|publisher=ChemComm|doi=10.1039/c3cc46778c|year=2013|issue=49|accessdate=2016-11-13|archive-date=2016-11-14|archive-url=https://web.archive.org/web/20161114001716/http://web.pkusz.edu.cn/huang/files/2013/04/Synthesis-of-%CE%B1%CE%B2-unsaturated-carbonyl-compounds-via-a-visible-light-promoted-organocatalytic-aerobic-oxidation.pdf|dead-url=no}}</ref>2006年[[福山透]]运用这个方法完成了对[[吗啡]]的全合成,这个氧化方法能兼容分子中的[[氨基甲酸酯]]和[[烯丙基]][[醚]]结构<ref name="Uchida">{{cite journal|author=Uchida, K.; Yokoshima, S.; Kan, T.; Fukuyama, T.|journal=[[Organic Letters]]|year=2006|volume=8|pages=5311|title=Total Synthesis of (±)-Morphine|doi=10.1021/ol062112m}}</ref>。 |
||
[[File:FukuyamaMorphineSaegusa.png|center|500px|Fukuyama对吗啡的合成]]{{#tag:ref|THF:[[四氢呋喃]];LiHMDS:[[二(三甲基硅基)氨基锂]];TMSCl:[[三甲基氯硅烷]]|group=注}} |
[[File:FukuyamaMorphineSaegusa.png|center|500px|Fukuyama对吗啡的合成]]{{#tag:ref|THF:[[四氢呋喃]];LiHMDS:[[二(三甲基硅基)氨基锂]];TMSCl:[[三甲基氯硅烷]]|group=注}} |
||
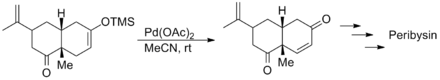
[[塞缪尔·丹尼谢夫斯基]]以手性的[[香芹酮]]和3-三甲基硅氧基-1,3-丁二烯经过[[狄尔斯-阿尔德反应|D-A反应]]得到的产物为原料,利用三枝–伊藤氧化反应分别完成了对天然产物Peribysin E(一种艾里莫芬烷类[[倍半萜]]<ref>{{cite journal|author=Takeshi Yamada, Masashi Iritani, Katsuhiko Minoura, Kenzo Kawai and Atsushi Numata|title=Peribysins A–D, potent cell-adhesion inhibitors from a sea hare-derived culture of Periconia species|journal=Org. Biomol. Chem.|year=2004|issue=2|pages=2131-2135|doi=10.1039/B404459B|url=http://pubs.rsc.org/en/Content/ArticleLanding/2004/OB/b404459b}}</ref>)的两种[[对映异构体]]的全合成,底物分子中的[[烯烃]]和[[羰基]]能耐受这个氧化反应。<ref name="Angeles">{{cite journal|author=Angeles, A. R.; Waters, S. P.; Danishefsky, S. J.|journal=Journal of the American Chemical Society|year=2008|volume=130|pages=13765|doi=10.1021/ja8048207|title=Total Syntheses of (+)- and (−)-Peribysin E|url=http://pubs.acs.org/doi/pdf/10.1021/ja8048207}}</ref> |
[[塞缪尔·丹尼谢夫斯基]]以手性的[[香芹酮]]和3-三甲基硅氧基-1,3-丁二烯经过[[狄尔斯-阿尔德反应|D-A反应]]得到的产物为原料,利用三枝–伊藤氧化反应分别完成了对天然产物Peribysin E(一种艾里莫芬烷类[[倍半萜]]<ref>{{cite journal|author=Takeshi Yamada, Masashi Iritani, Katsuhiko Minoura, Kenzo Kawai and Atsushi Numata|title=Peribysins A–D, potent cell-adhesion inhibitors from a sea hare-derived culture of Periconia species|journal=Org. Biomol. Chem.|year=2004|issue=2|pages=2131-2135|doi=10.1039/B404459B|url=http://pubs.rsc.org/en/Content/ArticleLanding/2004/OB/b404459b|access-date=2012-08-30|archive-date=2016-12-22|archive-url=https://web.archive.org/web/20161222031847/http://pubs.rsc.org/en/Content/ArticleLanding/2004/OB/B404459B|dead-url=no}}</ref>)的两种[[对映异构体]]的全合成,底物分子中的[[烯烃]]和[[羰基]]能耐受这个氧化反应。<ref name="Angeles">{{cite journal|author=Angeles, A. R.; Waters, S. P.; Danishefsky, S. J.|journal=Journal of the American Chemical Society|year=2008|volume=130|pages=13765|doi=10.1021/ja8048207|title=Total Syntheses of (+)- and (−)-Peribysin E|url=http://pubs.acs.org/doi/pdf/10.1021/ja8048207|access-date=2012-08-20|archive-date=2021-10-18|archive-url=https://web.archive.org/web/20211018134220/https://pubs.acs.org/doi/pdf/10.1021/ja8048207}}</ref> |
||
[[File:DanishefskyPeribysinSaegusa.png|center|440px|丹尼谢夫斯基对peribysin的合成]] |
[[File:DanishefskyPeribysinSaegusa.png|center|440px|丹尼谢夫斯基对peribysin的合成]] |
||
| 第48行: | 第53行: | ||
[[File:OvermanLaurenyneSaegusa.png|center|500px|Overman synthesis of laurenyne]]{{#tag:ref|PCC:[[氯铬酸吡啶盐]];NaAc:[[醋酸钠]];DCM:[[二氯甲烷]];TMSOTf:三氟甲磺酸三甲基硅基酯;Et<sub>3</sub>N:[[三乙胺]]|group=注}} |
[[File:OvermanLaurenyneSaegusa.png|center|500px|Overman synthesis of laurenyne]]{{#tag:ref|PCC:[[氯铬酸吡啶盐]];NaAc:[[醋酸钠]];DCM:[[二氯甲烷]];TMSOTf:三氟甲磺酸三甲基硅基酯;Et<sub>3</sub>N:[[三乙胺]]|group=注}} |
||
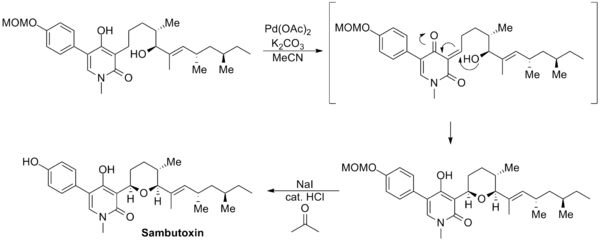
大衛·威廉姆斯(David Williams)设计了一种新的三枝-伊藤氧化反应通过对底物分子中未保护的[[烯醇]]部分进行氧化来合成Sambutoxin。先是发生烯醇的氧化得到中间体烯酮,随后烯酮的部分受到分子内亲核试剂羟基的进攻,原位重新生成烯醇同时形成一个五元环的[[四氢呋喃]]结构。最后通过甲氧基甲基的脱保护完成这个天然产物的合成<ref name="Williams">{{cite|author=Williams, D.R.; Tuske, R.A.|title=Construction of 4-Hydroxy-2-pyridinones. Total Synthesis of (+)-Sambutoxin|journal=Org. Lett.|url=http://pubs.acs.org/doi/abs/10.1021/ol006410%2B|volume=2|issue=20|year=2000|pages=3217–3220|doi=10.1021/ol006410+|accessdate=2012-08-21|archive-date=2021-10-18|archive-url=https://web.archive.org/web/20211018135644/https://pubs.acs.org/doi/abs/10.1021/ol006410%2B}}</ref>。 |
|||
[[File:WilliamsSambutoxinSaegusa.png|center|600px|Williams sambutoxin synthesis]]{{#tag:ref|MOM:甲氧基甲基|group=注}} |
[[File:WilliamsSambutoxinSaegusa.png|center|600px|Williams sambutoxin synthesis]]{{#tag:ref|MOM:甲氧基甲基|group=注}} |
||
== 反应的变体 == |
== 反应的变体 == |
||
该氧化反应最大的一个缺点就是需要耗费化学当量的醋酸钯,即使是原始文献中所报道的方法,通过加入氧化剂[[对苯醌]]从而能相对减少醋酸钯的用量,但即使这样也需要加入0.5当量的醋酸钯,而理论上讲是能将反应所需的醋酸钯减至催化量的。有效地将反应生成的零价钯氧化再生是将醋酸钯用量减至催化量的关键。所以Larock(Richard C. Larock)对这个反应条件做了改进,在以[[二甲基亚砜|DMSO]]溶剂的氧气氛围中使零价钯氧化再生,使得反应所需的醋酸钯用量降至催化量。<ref>{{cite journal|author=Larock, R. C.; Hightower, T. R.; Kraus, G. A.; Hahn, P.; Zheng, D.|journal=[[四面体通讯|Tetrahedron Letters]]|year=1995|volume=36|pages=2423|doi=10.1016/0040-4039(95)00306-w|title=A simple, effective, new, palladium-catalyzed conversion of enol silanes to enones and enals|url=http://www.sciencedirect.com/science/article/pii/004040399500306W}}</ref> |
该氧化反应最大的一个缺点就是需要耗费化学当量的醋酸钯,即使是原始文献中所报道的方法,通过加入氧化剂[[对苯醌]]从而能相对减少醋酸钯的用量,但即使这样也需要加入0.5当量的醋酸钯,而理论上讲是能将反应所需的醋酸钯减至催化量的。有效地将反应生成的零价钯氧化再生是将醋酸钯用量减至催化量的关键。所以Larock(Richard C. Larock)对这个反应条件做了改进,在以[[二甲基亚砜|DMSO]]溶剂的氧气氛围中使零价钯氧化再生,使得反应所需的醋酸钯用量降至催化量。<ref>{{cite journal|author=Larock, R. C.; Hightower, T. R.; Kraus, G. A.; Hahn, P.; Zheng, D.|journal=[[四面体通讯|Tetrahedron Letters]]|year=1995|volume=36|pages=2423|doi=10.1016/0040-4039(95)00306-w|title=A simple, effective, new, palladium-catalyzed conversion of enol silanes to enones and enals|url=http://www.sciencedirect.com/science/article/pii/004040399500306W|access-date=2012-08-21|archive-date=2020-06-24|archive-url=https://web.archive.org/web/20200624224604/https://www.sciencedirect.com/science/article/pii/004040399500306W}}</ref> |
||
[[File: |
[[File:LarockCatalyticSaegusa.svg|center|320px|Catalytic Saegusa–Ito oxidation utilizing oxygen as a co-oxidant]] |
||
但是拉洛克改进后的反应条件会大大延长反应的时间同时产物收率也会显著降低,[[西田笃]](Atsushi Nishida)等人在用三枝–伊藤氧化反应合成Platyphyllide时就采取和拉洛克截然相反的策略,即不额外加入[[氧化剂]]而是使用等当量的醋酸钯,则反应仅需较短的时间就能完成且产物有较高的收率,这两种方法的反差就凸显了使用催化量醋酸钯方法的缺点。<ref name="Hiraoka">{{cite|author=Hiraoka, S.; Harada, S.; Nishida, A.|journal=The Journal of Organic Chemistry|year=2010|volume=75|pages=3871|doi=10.1021/jo1003746|title=Catalytic Enantioselective Total Synthesis of (−)-Platyphyllide and Its Structural Revision|url=http://pubs.acs.org/doi/abs/10.1021/jo1003746}}</ref> |
但是拉洛克改进后的反应条件会大大延长反应的时间同时产物收率也会显著降低,[[西田笃]](Atsushi Nishida)等人在用三枝–伊藤氧化反应合成Platyphyllide时就采取和拉洛克截然相反的策略,即不额外加入[[氧化剂]]而是使用等当量的醋酸钯,则反应仅需较短的时间就能完成且产物有较高的收率,这两种方法的反差就凸显了使用催化量醋酸钯方法的缺点。<ref name="Hiraoka">{{cite|author=Hiraoka, S.; Harada, S.; Nishida, A.|journal=The Journal of Organic Chemistry|year=2010|volume=75|pages=3871|doi=10.1021/jo1003746|title=Catalytic Enantioselective Total Synthesis of (−)-Platyphyllide and Its Structural Revision|url=http://pubs.acs.org/doi/abs/10.1021/jo1003746|accessdate=2012-08-21|archive-date=2021-10-18|archive-url=https://web.archive.org/web/20211018134331/https://pubs.acs.org/doi/abs/10.1021/jo1003746}}</ref> |
||
[[File:NishidaPlatyphilideSaegusa.png|center|600px|Synthesis of Platyphillide]]{{#tag:ref|rt表示为“室温”|group=注}} |
[[File:NishidaPlatyphilideSaegusa.png|center|600px|Synthesis of Platyphillide]]{{#tag:ref|rt表示为“室温”|group=注}} |
||
| 第68行: | 第73行: | ||
[[File:IharaCedranoxideSaegusa.png|center|600px|(±)-8,14-环氧柏木烷的合成]]{{#tag:ref|TBDMS:叔丁基二甲基硅基;(±)-8,14-Cedranoxide:(±)-8,14-环氧柏木烷|group=注}} |
[[File:IharaCedranoxideSaegusa.png|center|600px|(±)-8,14-环氧柏木烷的合成]]{{#tag:ref|TBDMS:叔丁基二甲基硅基;(±)-8,14-Cedranoxide:(±)-8,14-环氧柏木烷|group=注}} |
||
利用零价钯的[[配合物]]能对烯丙基碳酸酯发生[[氧化加成]]二价的烯丙基钯络合物的性质,[[辻二郎]]发展了一种以碳酸二烯丙基酯为氧化剂的三枝–伊藤氧化反应,也是只需使用催化量的醋酸钯并加入相同催化量的[[二膦|双膦配体]][[1,2-双(二苯基膦)乙烷|dppe]]就能高效地实现该反应<ref name="Tsuji">{{cite|author=Tsuji, J.; Minami, I.; Shimizu, I.|journal=[[Tetrahedron Letters]]|year=1983|volume=24|pages=5635|doi=10.1016/s0040-4039(00)94160-1|title=A novel palladium-catalyzed preparative method of α,β-unsaturated ketones and aldehydes from saturated ketones and aldehydes via their silyl enol ethers|url=http://www.sciencedirect.com/science/article/pii/S0040403900941601}}</ref> |
利用零价钯的[[配合物]]能对烯丙基碳酸酯发生[[氧化加成]]二价的烯丙基钯络合物的性质,[[辻二郎]]发展了一种以碳酸二烯丙基酯为氧化剂的三枝–伊藤氧化反应,也是只需使用催化量的醋酸钯并加入相同催化量的[[二膦|双膦配体]][[1,2-双(二苯基膦)乙烷|dppe]]就能高效地实现该反应,选择适当的溶剂是实现该方法的关键:只有使用[[乙腈]]作为溶剂才能生成烯酮,而使用[[乙醚]]作溶剂则会发生[[Trost不对称烯丙位烷化反应|烯丙基取代反应]]生成α-烯丙基羰基化合物。<ref name="Tsuji">{{cite|author=Tsuji, J.; Minami, I.; Shimizu, I.|journal=[[Tetrahedron Letters]]|year=1983|volume=24|pages=5635|doi=10.1016/s0040-4039(00)94160-1|title=A novel palladium-catalyzed preparative method of α,β-unsaturated ketones and aldehydes from saturated ketones and aldehydes via their silyl enol ethers|url=http://www.sciencedirect.com/science/article/pii/S0040403900941601|accessdate=2012-08-21|archive-date=2020-06-24|archive-url=https://web.archive.org/web/20200624224619/https://www.sciencedirect.com/science/article/pii/S0040403900941601}}</ref> |
||
[[File:TsujiAllylcarbonateSaegusa. |
[[File:TsujiAllylcarbonateSaegusa.svg|center|350px|Catalytic Saegusa–Ito oxidation using diallylcarbonate as a co-oxidant]]{{#tag:ref|diallycarbonate:碳酸二烯丙基酯|group=注}} |
||
[[辻二郎]]改进后的 |
[[辻二郎]]改进后的三枝-伊藤氧化反应作为一种合成工具在天然化合物的全合成中已经取得了成功,[[柴崎正胜]]利用这个方法成功地合成了[[马钱子碱]]<ref name="Ohshima">{{cite|author=Ohshima, T.; Xu, Y.; Takita, R.; Shimizu, S.; Zhong, D.; Shibasaki, M.|journal=Journal of the American Chemical Society|title=Enantioselective Total Synthesis of (−)-Strychnine Using the Catalytic Asymmetric Michael Reaction and Tandem Cyclization|year=2002|volume=124|pages=14546|doi=10.1021/ja028457r|url=http://pubs.acs.org/doi/abs/10.1021/ja028457r|accessdate=2012-08-21|archive-date=2019-01-12|archive-url=https://web.archive.org/web/20190112064523/https://pubs.acs.org/doi/abs/10.1021/ja028457r|dead-url=no}}</ref>。 |
||
[[File:ShibasakiStrychnineSaegusa.png|center|600px|Shibasaki synthesis of strychnine]]{{#tag:ref|THF:[[四氢呋喃]];LTMP:[[氨基锂|2,2,6,6-四甲基哌啶锂]];TMSCl:[[三甲基氯硅烷]];Pd<sub>2</sub>(dba)<sub>3</sub>:[[三(二亚苄基丙酮)二钯]];Strychnine:[[马钱子碱]]|group=注}} |
[[File:ShibasakiStrychnineSaegusa.png|center|600px|Shibasaki synthesis of strychnine]]{{#tag:ref|THF:[[四氢呋喃]];LTMP:[[氨基锂|2,2,6,6-四甲基哌啶锂]];TMSCl:[[三甲基氯硅烷]];Pd<sub>2</sub>(dba)<sub>3</sub>:[[三(二亚苄基丙酮)二钯]];Strychnine:[[马钱子碱]]|group=注}} |
||
| 第88行: | 第93行: | ||
[[Category:人名反应]] |
[[Category:人名反应]] |
||
[[Category:有机氧化还原反应]] |
[[Category:有机氧化还原反应]] |
||
{{ |
{{Good article}} |
||
[[en:Saegusa–Ito oxidation]] |
|||
[[ja:三枝・伊藤酸化]] |
|||
2024年10月8日 (二) 01:25的最新版本
三枝–伊藤氧化反应(英語:Saegusa–Ito oxidation)是有机化学中一个将碳-碳单键转变为碳-碳双键的反应。这个在羰基化合物中引入α,β-不饱和结构的方法是由京都大学的三枝武夫和伊藤嘉彦在1978年发现的[1]。最初报道的方法是先将酮转化为相应的烯醇硅醚,接着将烯醇硅醚与醋酸钯和对苯醌反应从而产生α,β-不饱和羰基化合物。最早的原始文献指出可利用产物中新形成的不饱和双键,通过亲核试剂(比如有机铜试剂)对其进行1,4-加成反应以达到进一步衍生化的目的。
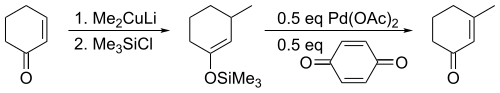
对于非环状底物,反应只会得到热力学产物反式烯酮。
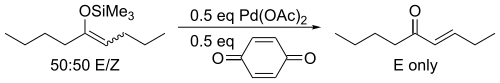
实际上在三枝武夫和伊藤嘉彦发表这一发现的八年之前,就已有一篇文献报道称可用未活化的酮和醋酸钯反应亦能得到相同的产物,但产率较低[2]。三枝和伊藤为此对这一反应所做的重大改进就是明确了烯醇式是反应的活性物种,并由此开发出了这种基于烯醇硅醚的方法。通过先将醛或酮用强碱性的2,2,6,6-四甲基哌啶锂或二异丙基氨基锂处理,发生去质子化生成烯醇负离子中间体,后加入三甲基氯硅烷捕获负离子中间体的方法可以方便地合成三枝氧化所用的原料烯醇硅醚。由于这个烯醇硅醚合成方法的副产物仅为氯化锂和胺,它们对后续的氧化反应没有较大影响并且烯醇硅醚容易水解,所以用这个方法合成出的烯醇硅醚可不经分离纯化直接用于接下来的三枝氧化反应[3][4]。
反应通常采用非催化量的钯,故一般对于工业生产来说成本过高,不过人们已在催化剂变体的开发上已经取得了一些进展。虽然该方法存在缺点,但三枝氧化反应依然是一个温和的合成方法,可用于在合成路线的尾端向具有多种官能团的复杂分子中引入新的官能团。
反应机理
[编辑]三枝–伊藤氧化反应的机理如下:首先是二价钯与烯醇硅醚双键的配位,随后三甲基硅基与醋酸根形成三甲基硅基醋酸酯离去,同时形成烯醇钯物种,接着发生β-氢消除得到钯氢物种的烯酮络合物,最后钯氢物种发生还原消除得到产物同时生成醋酸和零价钯[5]。β-氢消除步骤是一个存在化学平衡的可逆反应,所以对于非环状的底物,反应会选择性地生成反式双键构型的热力学产物。有证据显示零价钯会与反应产物形成类似Pd2(dba)3的配合物,使得零价钯很难被氧化再生。[6][7]
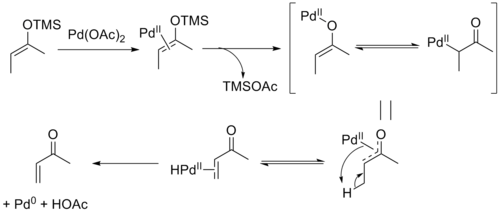
以对苯醌为氧化剂可将零价的钯氧化使二价钯再生:
- (重新进入循环)
应用
[编辑]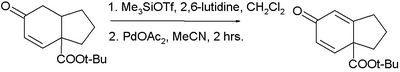
三枝-伊藤氧化反应是在羰基旁边引入碳-碳双键的有效手段,常被用于天然化合物分子的全合成中。[10]2006年福山透运用这个方法完成了对吗啡的全合成,这个氧化方法能兼容分子中的氨基甲酸酯和烯丙基醚结构[11]。
塞缪尔·丹尼谢夫斯基以手性的香芹酮和3-三甲基硅氧基-1,3-丁二烯经过D-A反应得到的产物为原料,利用三枝–伊藤氧化反应分别完成了对天然产物Peribysin E(一种艾里莫芬烷类倍半萜[12])的两种对映异构体的全合成,底物分子中的烯烃和羰基能耐受这个氧化反应。[13]
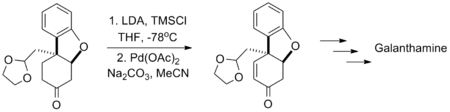
兰州大学的涂永强应用三枝–伊藤氧化反应全合成可用于治疗阿兹海默病的药物加兰他敏,由于反应是在存在碳酸钠的碱性条件下进行的,所以反应底物中的缩醛结构不受影响。[14]
Larry E. Overman利用“一锅法”连续进行了两步氧化反应用以合成天然产物Laurenyne,先将含有羟基的底物分子用氯铬酸吡啶盐将醇氧化成醛,紧接着利用三枝–伊藤氧化将中间体醛氧化成α,β-不饱和醛,底物分子中的氯代烷和磺酸酯结构均不受反应的影响[15]。
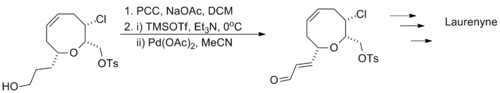
大衛·威廉姆斯(David Williams)设计了一种新的三枝-伊藤氧化反应通过对底物分子中未保护的烯醇部分进行氧化来合成Sambutoxin。先是发生烯醇的氧化得到中间体烯酮,随后烯酮的部分受到分子内亲核试剂羟基的进攻,原位重新生成烯醇同时形成一个五元环的四氢呋喃结构。最后通过甲氧基甲基的脱保护完成这个天然产物的合成[16]。
反应的变体
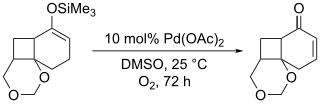
[编辑]该氧化反应最大的一个缺点就是需要耗费化学当量的醋酸钯,即使是原始文献中所报道的方法,通过加入氧化剂对苯醌从而能相对减少醋酸钯的用量,但即使这样也需要加入0.5当量的醋酸钯,而理论上讲是能将反应所需的醋酸钯减至催化量的。有效地将反应生成的零价钯氧化再生是将醋酸钯用量减至催化量的关键。所以Larock(Richard C. Larock)对这个反应条件做了改进,在以DMSO溶剂的氧气氛围中使零价钯氧化再生,使得反应所需的醋酸钯用量降至催化量。[17]
但是拉洛克改进后的反应条件会大大延长反应的时间同时产物收率也会显著降低,西田笃(Atsushi Nishida)等人在用三枝–伊藤氧化反应合成Platyphyllide时就采取和拉洛克截然相反的策略,即不额外加入氧化剂而是使用等当量的醋酸钯,则反应仅需较短的时间就能完成且产物有较高的收率,这两种方法的反差就凸显了使用催化量醋酸钯方法的缺点。[18]
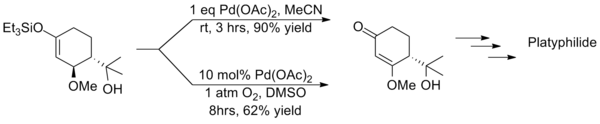
佐佐木诚等人在合成(−)-Gambierol的过程中也使用三枝–伊藤氧化反应来构筑(-)-Gambierol分子中的一个三并环的片段,他们采取和西田笃相同的策略,因为反应的规模很小,为追求较高的产率和较快的转化速率而使用了大大过量的醋酸钯,使氧化反应在不到一个小时的时间内就完成了[19]。
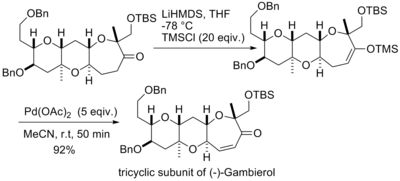
井原正隆等人利用经拉洛克改进后的反应条件合成了天然化合物(±)-8,14-雪松二醇和(±)-8,14-环氧柏木烷[20]。
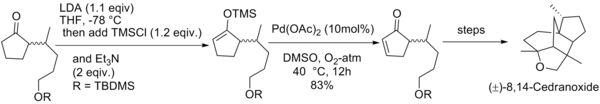
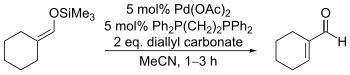
利用零价钯的配合物能对烯丙基碳酸酯发生氧化加成二价的烯丙基钯络合物的性质,辻二郎发展了一种以碳酸二烯丙基酯为氧化剂的三枝–伊藤氧化反应,也是只需使用催化量的醋酸钯并加入相同催化量的双膦配体dppe就能高效地实现该反应,选择适当的溶剂是实现该方法的关键:只有使用乙腈作为溶剂才能生成烯酮,而使用乙醚作溶剂则会发生烯丙基取代反应生成α-烯丙基羰基化合物。[21]
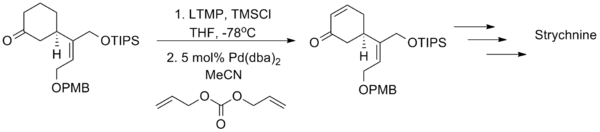
辻二郎改进后的三枝-伊藤氧化反应作为一种合成工具在天然化合物的全合成中已经取得了成功,柴崎正胜利用这个方法成功地合成了马钱子碱[22]。
注释
[编辑]- ^ 第一步中试剂为三氟甲磺酸三甲基硅酯和2,6-二甲基吡啶
- ^ THF:四氢呋喃;LiHMDS:二(三甲基硅基)氨基锂;TMSCl:三甲基氯硅烷
- ^ LDA:二异丙基氨基锂;TMSCl:三甲基氯硅烷;THF:四氢呋喃
- ^ PCC:氯铬酸吡啶盐;NaAc:醋酸钠;DCM:二氯甲烷;TMSOTf:三氟甲磺酸三甲基硅基酯;Et3N:三乙胺
- ^ MOM:甲氧基甲基
- ^ rt表示为“室温”
- ^ Bn:苄基
TBS:叔丁基二甲基硅基;TMSCl:三甲基氯硅烷;r.t表示为“室温” - ^ TBDMS:叔丁基二甲基硅基;(±)-8,14-Cedranoxide:(±)-8,14-环氧柏木烷
- ^ diallycarbonate:碳酸二烯丙基酯
- ^ THF:四氢呋喃;LTMP:2,2,6,6-四甲基哌啶锂;TMSCl:三甲基氯硅烷;Pd2(dba)3:三(二亚苄基丙酮)二钯;Strychnine:马钱子碱
参见
[编辑]参考资料
[编辑]- ^ Ito,Yoshihiko; Hirao,Toshikazu; Saegusa,Takeo, Synthesis of .alpha.,.beta.-unsaturated carbonyl compounds by palladium(II)-catalyzed dehydrosilylation of silyl enol ethers, Journal of Organic Chemistry, 1978, 43 (5): 1011–1013, doi:10.1021/jo00399a052
- ^ Theissen, R. J., Preparation of .alpha.,.beta.-unsaturated carbonyl compunds, Journal of Organic Chemistry, 1971, 36: 752, doi:10.1021/jo00805a004
- ^ Brownbridge, P. Silyl Enol Ethers in Synthesis - Part I. Synthesis. 1983: 1-28. doi:10.1055/s-1983-30204.
- ^ Brownbridge, P. Silyl Enol Ethers in Synthesis - Part II. Synthesis. 1983: 85–104. doi:10.1055/s-1983-30234.
- ^ Oxidation (页面存档备份,存于互联网档案馆), Chem 215 lecture notes
- ^ Porth, S.; Bats, J. W.; Trauner, D.; Giester, G.; Mulzer, J., Insight into the Mechanism of the Saegusa Oxidation: Isolation of a Novel Palladium(0)–Tetraolefin Complex, Angewandte Chemie International Edition, 1999, 38: 2015, doi:10.1002/(sici)1521-3773(19990712)38:13/14<2015::aid-anie2015>3.0.co;2-#
- ^ Toyota, M.; Ihara, M. Development of Palladium-catalyzed cycloalkenylation and its application to natural product synthesis.. Synlett. 2000, (8): 1211–1222. doi:10.1055/s-2002-32946.
- ^ Laszlo Kurti, Barbara Czako. Strategic Applications of Named Reactions in Organic Synthesis. 2005: 390-391. ISBN 0124297854.
- ^ Derrick L. J. Clive and Rajesh Sunasee. Formation of Benzo-Fused Carbocycles by Formal Radical Cyclization onto an Aromatic Ring. Org. Lett. 2007, 9 (14): 2677–2680. doi:10.1021/ol070849l.
- ^ Junlin Zhang, Leming Wang, Qi Liu, Zhen Yang and Yong Huang, Synthesis of a,b-unsaturated carbonyl compounds via a visible-light-promoted organocatalytic aerobic oxidation (PDF) (49), ChemComm, 2013 [2016-11-13], doi:10.1039/c3cc46778c, (原始内容存档 (PDF)于2016-11-14)
- ^ Uchida, K.; Yokoshima, S.; Kan, T.; Fukuyama, T. Total Synthesis of (±)-Morphine. Organic Letters. 2006, 8: 5311. doi:10.1021/ol062112m.
- ^ Takeshi Yamada, Masashi Iritani, Katsuhiko Minoura, Kenzo Kawai and Atsushi Numata. Peribysins A–D, potent cell-adhesion inhibitors from a sea hare-derived culture of Periconia species. Org. Biomol. Chem. 2004, (2): 2131–2135 [2012-08-30]. doi:10.1039/B404459B. (原始内容存档于2016-12-22).
- ^ Angeles, A. R.; Waters, S. P.; Danishefsky, S. J. Total Syntheses of (+)- and (−)-Peribysin E. Journal of the American Chemical Society. 2008, 130: 13765 [2012-08-20]. doi:10.1021/ja8048207. (原始内容存档于2021-10-18).
- ^ Hu, X.-D.; Tu, Y. Q.; Zhang, E.; Gao, S.; Wang, S.; Wang, A.; Fan, C.-A.; Wang, M. Total Synthesis of (±)-Galanthamine. Organic Letters. 2006, 8: 1823. doi:10.1021/ol060339b.
- ^ Overman, L. E.; Thompson, A. S. Total synthesis of (-)-laurenyne. Use of acetal-initiated cyclizations to prepare functionalized eight-membered cyclic ethers.. J. Am. Chem. Soc. 1988, 110: 2248. doi:10.1021/ja00215a040.
- ^ Williams, D.R.; Tuske, R.A., Construction of 4-Hydroxy-2-pyridinones. Total Synthesis of (+)-Sambutoxin, Org. Lett., 2000, 2 (20): 3217–3220 [2012-08-21], doi:10.1021/ol006410+, (原始内容存档于2021-10-18)
- ^ Larock, R. C.; Hightower, T. R.; Kraus, G. A.; Hahn, P.; Zheng, D. A simple, effective, new, palladium-catalyzed conversion of enol silanes to enones and enals. Tetrahedron Letters. 1995, 36: 2423 [2012-08-21]. doi:10.1016/0040-4039(95)00306-w. (原始内容存档于2020-06-24).
- ^ Hiraoka, S.; Harada, S.; Nishida, A., Catalytic Enantioselective Total Synthesis of (−)-Platyphyllide and Its Structural Revision, The Journal of Organic Chemistry, 2010, 75: 3871 [2012-08-21], doi:10.1021/jo1003746, (原始内容存档于2021-10-18)
- ^ Haruhiko Fuwa, Noriko Kainuma, Kazuo Tachibana, and Makoto Sasaki. Total Synthesis of (−)-Gambierol. J. Am. Chem. Soc. 2002, 124 (50): 14983. doi:10.1021/ja028167a.
- ^ Masataka Ihara, Kei Makita , and Kiyosei Takasu. Facile Construction of the Tricyclo [5.2.1.01,5]decane Ring System by Intramolecular Double Michael Reaction: Highly Stereocontrolled Total Synthesis of (±)-8,14-Cedranediol and (±)-8,14-Cedranoxide. J. Org. Chem. 1999, 64 (4): 1259–1264. doi:10.1021/jo981996n.
- ^ Tsuji, J.; Minami, I.; Shimizu, I., A novel palladium-catalyzed preparative method of α,β-unsaturated ketones and aldehydes from saturated ketones and aldehydes via their silyl enol ethers, Tetrahedron Letters, 1983, 24: 5635 [2012-08-21], doi:10.1016/s0040-4039(00)94160-1, (原始内容存档于2020-06-24)
- ^ Ohshima, T.; Xu, Y.; Takita, R.; Shimizu, S.; Zhong, D.; Shibasaki, M., Enantioselective Total Synthesis of (−)-Strychnine Using the Catalytic Asymmetric Michael Reaction and Tandem Cyclization, Journal of the American Chemical Society, 2002, 124: 14546 [2012-08-21], doi:10.1021/ja028457r, (原始内容存档于2019-01-12)





