氨基锂:修订间差异
外观
删除的内容 添加的内容
无编辑摘要 |
小 + |
||
| (未显示2个用户的3个中间版本) | |||
| 第6行: | 第6行: | ||
| ImageFileR1 = Li+.svg |
| ImageFileR1 = Li+.svg |
||
| ImageSizeR1 = 33px |
| ImageSizeR1 = 33px |
||
| IUPACName = |
| IUPACName = Lithium amide |
||
| OtherNames = 氨基化锂 |
| OtherNames = 氨基化锂 |
||
| Section1 = {{Chembox Identifiers |
| Section1 = {{Chembox Identifiers |
||
| CASNo = 7782-89-0 |
| CASNo = 7782-89-0 |
||
| CASNo_Ref = {{cascite| |
| CASNo_Ref = {{cascite|correct|CAS}} |
||
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}}| ChemSpiderID = 22939 |
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}}| ChemSpiderID = 22939 |
||
| InChI = 1/Li.H2N/h;1H2/q+1;-1 |
| InChI = 1/Li.H2N/h;1H2/q+1;-1 |
||
| 第66行: | 第66行: | ||
== 其他氨基锂 == |
== 其他氨基锂 == |
||
由[[胺]]的共轭碱形成的化合物称为[[氨基化物]]。因此'''氨基锂'''可能也指胺的锂[[盐]],例如Li<sup>+</sup>NR<sub>2</sub><sup>-</sup>。一个常见的例子是[[二异丙基氨基锂]](简称LDA),它在[[有机合成]]中是常用的强碱。 |
由[[胺]]的共轭碱形成的化合物称为[[氨基化物]]。因此'''氨基锂'''可能也指胺的锂[[盐 (化学)|盐]],例如Li<sup>+</sup>NR<sub>2</sub><sup>-</sup>。一个常见的例子是[[二异丙基氨基锂]](简称LDA),它在[[有机合成]]中是常用的强碱。 |
||
=== 例子 === |
=== 例子 === |
||
2024年10月20日 (日) 08:56的最新版本
| 氨基锂 | |||
|---|---|---|---|
| |||
| IUPAC名 Lithium amide | |||
| 别名 | 氨基化锂 | ||
| 识别 | |||
| CAS号 | 7782-89-0 | ||
| PubChem | 16211536 | ||
| ChemSpider | 22939 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | AFRJJFRNGGLMDW-UHFFFAOYAO | ||
| 性质 | |||
| 化学式 | LiNH2 | ||
| 摩尔质量 | 22.96 g·mol⁻¹ | ||
| 外观 | 白色固体 | ||
| 密度 | 1.178 g/cm3 | ||
| 熔点 | 390 °C | ||
| 沸点 | 430 °C | ||
| 溶解性(水) | 分解 | ||
| 危险性 | |||
| NFPA 704 | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
氨基锂是一种无机化合物,化学式为Li+NH2-。它由锂离子和氨基阴离子(氨的共轭碱)构成。它与氢化锂、亚氨基锂都是具有良好前景的储氢材料。
性质
[编辑]其他胺的锂盐可以用类似方法制备,也就是用相应的胺代替液氨:
工业上可由氢化锂与氨气反应制得,也可将金属锂直接在400℃下与氨气反应:
熔融的氨基锂呈绿色,冷却后恢复白色。在空气中氨基锂缓慢分解,对其加强热则猛烈分解,但不会爆炸。加热到450℃时,分解为亚氨基锂和氨气[1]。
氨基锂难溶于液氨,可溶于冷水,溶于热水迅速水解成氢氧化锂和氨气。 氨基锂是很活泼的化合物,具有强碱性。它们都是亲核性碱,除非氮原子由于空间位阻而无法进攻碳原子(例如LDA)。
结构
[编辑]氨基锂是一种白色固体,晶体结构属四方晶系,晶格常数a=501.6pm,c=1022pm,每个晶胞中含8个LiNH2[1]。
其他氨基锂
[编辑]由胺的共轭碱形成的化合物称为氨基化物。因此氨基锂可能也指胺的锂盐,例如Li+NR2-。一个常见的例子是二异丙基氨基锂(简称LDA),它在有机合成中是常用的强碱。
例子
[编辑]2,2,6,6-四甲基哌啶锂
[编辑]2,2,6,6-四甲基哌啶锂晶体是四聚体:
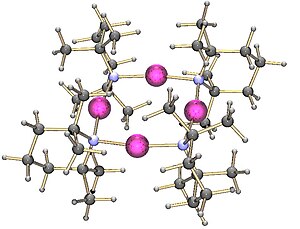
三聚体双(1-苯基乙基)氨基锂
[编辑]此外,双(1-苯基乙基)氨基锂晶体是三聚体:

制备醇盐和金属氨基化物的混合低聚体也是有可能的。[4]它们与醇盐和烷基锂配制成的超强碱类似。当氮原子与一个锂原子形成σ键并通过孤对电子与另一个金属原子形成配位键时,可以形成环状的低聚体。
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 张青莲. 《无机化学丛书》第一卷:稀有气体、氢、碱金属. 北京: 科学出版社. : P337. ISBN 7-03-002238-6.
- ^ M.F. Lappert, M.J. Slade, A. Singh, J.L. Atwood, R.D. Rogers and R. Shakir. Structure and reactivity of sterically hindered lithium amides and their diethyl etherates: crystal and molecular structures of [Li{N(SiMe3)2}(OEt2)]2 and tetrakis(2,2,6,6-tetramethylpiperidinatolithium). Journal of the American Chemical Society. 1983, 105 (2): 302–304. doi:10.1021/ja00340a031.
- ^ D.R. Armstrong, K.W. Henderson, A.R. Kennedy, W.J. Kerr, F.S. Mair, J.H. Moir, P.H. Moran and R. Snaith, Dalton Transactions, 1999, 4063.
- ^ K.W. Henderson, D.S. Walther and P.G. Williard. Identification of a Unimetal Complex of Bases by 6Li NMR Spectroscopy and Single-Crystal Analysis. Journal of the American Chemical Society. 1995, 117 (33): 8680–8681. doi:10.1021/ja00138a030.
- Merck Index, 11th Edition, 5398.








