碳-氟鍵:修订间差异
补救1个来源,并将0个来源标记为失效。 #IABot (v1.4) |
修飾語句 |
||
| (未显示11个用户的16个中间版本) | |||
| 第1行: | 第1行: | ||
{{RoughTranslation|en:Carbon–fluorine_bond}} |
{{RoughTranslation|en:Carbon–fluorine_bond}} |
||
[[Image:Carbon-fluorine-bond-polarity-2D-black. |
[[Image:Carbon-fluorine-bond-polarity-2D-black.svg|thumb|極性碳-氟鍵部分電荷分布]] |
||
'''碳-氟鍵'''是 |
'''碳-氟鍵'''是[[碳]]和[[氟]]間的[[極性]][[共价键|共價]][[單鍵]],是所有[[有機氟化合物]]的組分。甚有離子鍵特徵而相對較短,是很強的[[化學]]單鍵,僅次於硼-氟、矽-氟和氫-氟鍵。往[[化合物]]同一碳原子添加更多氟原子時,鍵會增強並縮短,因此[[四氟甲烷]](四氟化碳)等[[氟代烷]]是極不活潑的有機化合物。 |
||
==電負性和鍵 |
==電負性和鍵強== |
||
高[[電負性|電負]]的氟(氟:4.0,碳:2.5)賦予碳-氟鍵顯著的[[極性]]/[[電偶極矩]]。電子云集中在氟周圍,碳的電子云較稀疏。[[部分電荷]](C<sup>δ+</sup>—F<sup>δ−</sup>)使碳-氟鍵頗像離子鍵。氟和碳的部分電荷有吸引力,碳-氟鍵強得別樹一格。氟與碳形成「有機化學最強」的單鍵。<ref name=hagan>{{cite journal |author=O'Hagan D |title=Understanding organofluorine chemistry. An introduction to the C–F bond |journal=Chem Soc Rev |volume=37 |issue=2 |pages=308–19 |date=February 2008 |pmid=18197347 |doi=10.1039/b711844a |url=https://archive.org/details/sim_chemical-society-great-britain-chemical-society-reviews_2008-02_37_2/page/308}}</ref>碳-氟鍵的[[鍵解離能]](BDE;鍵強度)可高達每摩13萬卡,<ref name="Lemal2004">Lemal DM. [http://www.ncbi.nlm.nih.gov/pubmed/14703372 "Perspective on Fluorocarbon Chemistry"] {{Wayback|url=http://www.ncbi.nlm.nih.gov/pubmed/14703372 |date=20130524141144 }} J Org Chem. 2004, volume 69, p 1–11. {{doi|10.1021/jo0302556}}</ref>比其它碳-[[鹵素]]和碳-[[氫]]鍵的高。甲基-某的碳-某鍵離解能分別為每摩104.9、115、83.7、72.1和57.6 kcal(某為[[氫]]、氟、[[氯]]、[[溴]]和[[碘]])。<ref name=blanksby>{{cite journal |author=Blanksby SJ, Ellison GB |title=Bond dissociation energies of organic molecules |journal=Acc. Chem. Res. |volume=36 |issue=4 |pages=255–63 |date=April 2003 |pmid=12693923 |doi=10.1021/ar020230d |url=}}</ref> |
|||
== 鍵長 == |
== 鍵長 == |
||
碳-氟鍵通常長約1.35[[埃]](在[[氟甲烷]]為1.39埃),<ref name=hagan/>比其他碳-鹵鍵、碳-[[氮]]單鍵和碳-[[氧]]單鍵都短。如此長短可歸因於其離子特徵,碳和氟的部分電荷間有靜電引力。碳-氟鍵長取決於碳原子的混成及它或更遠原子的其它取代基,可有幾百分之一埃的變化。這些波動可作為微妙的混成變化和[[立體電子效應]]的跡象。下表顯示平均鍵長在不同鍵合環境如何變化(碳原子是sp³混成,除非另外說明是sp²或芳族碳)。 |
|||
碳 - 氟鍵長度通常為約1.35 [[埃格斯特朗| 埃(Å)]] ,([[氟甲烷]] 為1.39 Å).<ref name=hagan/> 比任何其他的碳 – [[鹵素|鹵]]的鍵還要短,並且比單個碳 – [[氮]],碳 – [[氧]]鍵短,儘管氟具有較大的[[原子質量]]。鍵的長短也可以歸因於碳和氟的局部電荷之間的離子特性/靜電引力。 |
|||
碳 - 氟鍵的長度幾百分之一埃,取決於碳原子的雜合(hybridization)和碳上其它取代基,甚至在離原子更遠的地方。這些波動可以作為細微的雜交變化和[[立體電子效應]]的跡象。下面的表格顯示了平均鍵長在不同的鍵合環境(碳原子數是sp<sup>3</sup>雜交,除非有另外指名是sp<sup>2</sup>或芳族碳)是如何變化的。 |
|||
:{| class="wikitable" |
:{| class="wikitable" |
||
|- |
|- |
||
! 鍵結 !!平均鍵長 |
! 鍵結 !!平均鍵長(埃)<ref>F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. ''J. Chem. Soc. Perkin Trans. II'' '''1987''', S1-S19.</ref> |
||
|- |
|- |
||
| CCH<sub>2</sub>F |
| CCH<sub>2</sub>F、C<sub>2</sub>CHF || 1.399 |
||
|- |
|- |
||
| C<sub>3</sub>CF || 1.428 |
| C<sub>3</sub>CF || 1.428 |
||
|- |
|- |
||
| C<sub>2</sub>CF<sub>2</sub> |
| C<sub>2</sub>CF<sub>2</sub>、H<sub>2</sub>CF<sub>2</sub>、CCHF<sub>2</sub> || 1.349 |
||
|- |
|- |
||
| CCF<sub>3</sub> || 1.346 |
| CCF<sub>3</sub> || 1.346 |
||
| 第35行: | 第33行: | ||
|} |
|} |
||
氟和其他元素間的鍵亦甚有離子特徵,鍵長稍短而多變,一直難以為氟選擇合適的[[共價半徑]]值。[[萊納斯·鮑林|包令]]最初提出64pm,但該值最終以氟-氟鍵長一半的72pm取代,然而72pm過長,代表不到氟和其他元素間的鍵長,故此其他作者提議54至60pm。<ref>Gillespie, Ronald, and Edward Robinson. 1992 Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine. ''Inorganic Chemistry, 31'', 1960-1963.</ref><ref>Robinson, Edward, Samuel Johnson, Ting-Hua Tang, and Ronald Gillespie. 1997. Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model. ''Inorganic Chemistry, 36'', 3022-3030.</ref><ref>Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán and Santiago Alvarez. Covalent radii revisited. ''Dalton Trans.'', '''2008''', 2832-2838, {{doi|10.1039/b801115j}}</ref><ref>P. Pyykkö, M. Atsumi, [[Chemistry: A European Journal|''Chem. Eur. J.'']], 15, '''2009''',186-197 {{doi|10.1002/chem.200800987}}.</ref> |
|||
==鍵 |
== 偕鍵的鍵強度效應 == |
||
[[偕]]碳的氟原子增多,其他鍵變強變短,可由氟甲烷系列的鍵長和強度(BDE)變化看出,如下表所示;原子部分電荷(''q''<sub>C</sub>和''q''<sub>F</sub>)隨氟數而變<ref name="Lemal2004"/>,加入氟時,碳的部分電荷變得更陽,氟碳間靜電相互作用和離子度增強。 |
|||
:{| class="wikitable" |
:{| class="wikitable" |
||
|- |
|- |
||
! 化合物 |
! 化合物 |
||
! 碳 |
! 碳氟鍵長(埃) |
||
!BDE(每摩幾千卡) |
|||
!BDE (kcal/mol) |
|||
!''q''<sub>C</sub> |
!''q''<sub>C</sub> |
||
!''q''<sub>F</sub> |
!''q''<sub>F</sub> |
||
| 第50行: | 第48行: | ||
|CH<sub>3</sub>F |
|CH<sub>3</sub>F |
||
|1.385 |
|1.385 |
||
|109.9 |
|109.9±1 |
||
|0.01 |
|0.01 |
||
| −0.23 |
| −0.23 |
||
| 第68行: | 第66行: | ||
|CF<sub>4</sub> |
|CF<sub>4</sub> |
||
|1.319 |
|1.319 |
||
|130.5 |
|130.5±3 |
||
|0.72 |
|0.72 |
||
| −0.18 |
| −0.18 |
||
| 第75行: | 第73行: | ||
==扭轉效應== |
==扭轉效應== |
||
[[Image: |
[[Image:Gauche effect.svg|250px|thumb|right|1,2-二氟乙烷的反式(左)和扭轉(gauche)(右)結構;下排為[[紐曼式|紐曼投影]]]] |
||
當2 |
當2粒氟原子是位在鄰位(即相鄰)的碳原子,如在1,2-二氟乙烷(H<sub>2</sub>FCCFH<sub>2</sub>)時,[[構象異構|扭轉構象]]比反構象更穩定,這是相反於大部分的1,2-二取代乙烷類通常會被預期到和觀察到;此現象稱為[[扭轉效應]](gauche effect) <ref name=Craig>''Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane'' Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser [[J. Am. Chem. Soc.]]; '''1997'''; 119(20) pp 4789 - 4790; (Communication) {{DOI|10.1021/ja963819e}}</ref>。1,2-二氟乙烷,該扭轉構象比反構象更穩定,在氣相中,更穩定2.4至3.4千焦/摩。這種效果不是指會出現在氟[[鹵素]],然而;扭轉效應也可以在1,2-二甲氧基乙烷觀察到。一個相關的效果是烯烴[[順反異構|順式]]作用。例如,1,2-二氟乙烯的順式異構體比反式異構體穩定。<ref>''The stereochemical consequences of electron delocalization in extended .pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes'' and related phenomena Richard C. Bingham [[J. Am. Chem. Soc.]]; '''1976'''; 98(2); 535-540 [http://pubs.acs.org/cgi-bin/abstract.cgi/jacsat/1976/98/i02/f-pdf/f_ja00418a036.pdf Abstract] {{Wayback|url=http://pubs.acs.org/cgi-bin/abstract.cgi/jacsat/1976/98/i02/f-pdf/f_ja00418a036.pdf |date=20070929134736 }}</ref> |
||
[[Image:Gauche effect hyperconjugation.png|thumb|left|用超共軛模型解釋1, |
[[Image:Gauche effect hyperconjugation.png|thumb|left|用超共軛模型解釋1,2-二氟乙烷的扭轉效應的影響]] |
||
這裡有兩個主要影響扭轉效應的解釋:[[超共軛]]和彎曲的鍵結。在超共軛的模型,從碳 |
這裡有兩個主要影響扭轉效應的解釋:[[超共軛]]和彎曲的鍵結。在超共軛的模型,從碳-氫σ鍵軌道到碳-氟σ<sup>*</sup>反鍵軌道的電子密度的捐贈被認為是穩定扭轉異構體的來源。由於氟更電負,碳-氫σ軌道比碳氟σ軌道是更好的電子供體,而碳-氟σ<sup>*</sup>軌道比碳-氫σ<sup>*</sup>軌道為一個更好的電子受體。只有扭轉構象允許在更好的供體和受體之間的良好重疊。 |
||
在二氟乙烷扭轉效應的彎曲鍵關鍵解釋是,在兩個碳 |
在二氟乙烷扭轉效應的彎曲鍵關鍵解釋是,在兩個碳-氟鍵增加[[p軌域]],由於氟的電負性大。其結果是電子密度建立在中央碳-碳鍵的上方、下方、左側和右側。由此此結果可以減少軌道重疊,當一個扭轉效應被假設,形成一個彎曲的鍵。在這兩種模式,超共軛通常被認為是二氟乙烷的扭轉效應的主因。<ref name=hagan/><ref>Goodman, L.; Gu, H.; Pophristic, V.. Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion. ''J. Phys. Chem. A.'' '''2005''', ''109'', 1223-1229. {{doi|10.1021/jp046290d}}</ref> |
||
==光譜分析== |
==光譜分析== |
||
在[[紅外光譜]] |
碳-氟鍵在[[紅外光譜]]的1000至1360cm⁻¹間伸縮。拉伸頻率對分子其他取代基敏感,出現範圍很闊。單氟化物在1000和1110cm⁻¹間有強頻帶;氟原子超過一粒,頻帶分成兩條,一條用於對稱模式,一條用於不對稱<ref>{{cite book |title=Infrared and Raman characteristic group frequencies: tables and charts |author=George Socrates, Socrates |publisher=John Wiley and Sons |year=2001 |isbn=0-470-09307-2 |pages=198}}</ref>,碳-氟帶非常強,可掩蓋任何碳-氫帶<ref>{{cite book |title=Infrared Spectroscopy: Fundamentals and Applications |url=https://archive.org/details/infraredspectros00stua_583 |author=Barbara H. Stuart |publisher=John Wiley and Sons |year=2004 |isbn=0-470-85428-6 |pages=[https://archive.org/details/infraredspectros00stua_583/page/n86 82]}}</ref>。 |
||
[[有機氟化合物]]也可 |
[[有機氟化合物]]也可用[[碳-13|碳13]]、[[氟-19|氟19]](氟的唯一天然同位素)或氫1(如有)[[NMR]]光譜表徵。取決於取代度和官能團,氟十九NMR中的[[化學位移]]有很闊的範圍。下表顯示一些主要類別的範圍。<ref>{{cite web |url=http://nmr.chem.indiana.edu/NMRguide/misc/19Fshifts.html |title=存档副本 |accessdate=2008-11-09 |deadurl=yes |archiveurl=https://web.archive.org/web/20080515131118/http://nmr.chem.indiana.edu/NMRguide/misc/19Fshifts.html |archivedate=2008-05-15 }}</ref> |
||
:{| class="wikitable" |
:{| class="wikitable" |
||
|- |
|- |
||
! 化合物類型 !! 化學位移範圍 |
! 化合物類型 !! 化學位移範圍(ppm)(與CFCl<sub>3</sub>比較) |
||
|- |
|- |
||
| F–C=O || −70 |
| F–C=O || −70至−20 |
||
|- |
|- |
||
| CF<sub>3</sub> || +40 |
| CF<sub>3</sub> || +40至+80 |
||
|- |
|- |
||
| CF<sub>2</sub> || +80 |
| CF<sub>2</sub> || +80至+140 |
||
|- |
|- |
||
| CF || +140 |
| CF || +140至+250 |
||
|- |
|- |
||
| ArF || +80 |
| ArF || +80至+170 |
||
|} |
|} |
||
== |
==參見== |
||
*[[有機氟化學]] |
*[[有機氟化學]] |
||
*[[氟氯碳化物]] |
*[[氟氯碳化物]] |
||
*[[鹵化]] |
|||
==參考文獻== |
==參考文獻== |
||
2023年4月7日 (五) 15:11的最新版本
此條目翻譯品質不佳,原文在en:Carbon–fluorine_bond。 |
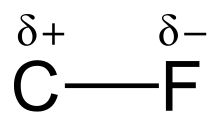
碳-氟鍵是碳和氟間的極性共價單鍵,是所有有機氟化合物的組分。甚有離子鍵特徵而相對較短,是很強的化學單鍵,僅次於硼-氟、矽-氟和氫-氟鍵。往化合物同一碳原子添加更多氟原子時,鍵會增強並縮短,因此四氟甲烷(四氟化碳)等氟代烷是極不活潑的有機化合物。
電負性和鍵強
[编辑]高電負的氟(氟:4.0,碳:2.5)賦予碳-氟鍵顯著的極性/電偶極矩。電子云集中在氟周圍,碳的電子云較稀疏。部分電荷(Cδ+—Fδ−)使碳-氟鍵頗像離子鍵。氟和碳的部分電荷有吸引力,碳-氟鍵強得別樹一格。氟與碳形成「有機化學最強」的單鍵。[1]碳-氟鍵的鍵解離能(BDE;鍵強度)可高達每摩13萬卡,[2]比其它碳-鹵素和碳-氫鍵的高。甲基-某的碳-某鍵離解能分別為每摩104.9、115、83.7、72.1和57.6 kcal(某為氫、氟、氯、溴和碘)。[3]
鍵長
[编辑]碳-氟鍵通常長約1.35埃(在氟甲烷為1.39埃),[1]比其他碳-鹵鍵、碳-氮單鍵和碳-氧單鍵都短。如此長短可歸因於其離子特徵,碳和氟的部分電荷間有靜電引力。碳-氟鍵長取決於碳原子的混成及它或更遠原子的其它取代基,可有幾百分之一埃的變化。這些波動可作為微妙的混成變化和立體電子效應的跡象。下表顯示平均鍵長在不同鍵合環境如何變化(碳原子是sp³混成,除非另外說明是sp²或芳族碳)。
鍵結 平均鍵長(埃)[4] CCH2F、C2CHF 1.399 C3CF 1.428 C2CF2、H2CF2、CCHF2 1.349 CCF3 1.346 FCNO2 1.320 FCCF 1.371 Csp2F 1.340 CarF 1.363 FCarCarF 1.340
氟和其他元素間的鍵亦甚有離子特徵,鍵長稍短而多變,一直難以為氟選擇合適的共價半徑值。包令最初提出64pm,但該值最終以氟-氟鍵長一半的72pm取代,然而72pm過長,代表不到氟和其他元素間的鍵長,故此其他作者提議54至60pm。[5][6][7][8]
偕鍵的鍵強度效應
[编辑]偕碳的氟原子增多,其他鍵變強變短,可由氟甲烷系列的鍵長和強度(BDE)變化看出,如下表所示;原子部分電荷(qC和qF)隨氟數而變[2],加入氟時,碳的部分電荷變得更陽,氟碳間靜電相互作用和離子度增強。
化合物 碳氟鍵長(埃) BDE(每摩幾千卡) qC qF CH3F 1.385 109.9±1 0.01 −0.23 CH2F2 1.357 119.5 0.40 −0.23 CHF3 1.332 127.5 0.56 −0.21 CF4 1.319 130.5±3 0.72 −0.18
扭轉效應
[编辑]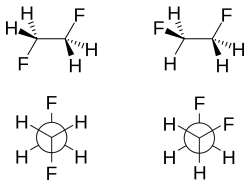
當2粒氟原子是位在鄰位(即相鄰)的碳原子,如在1,2-二氟乙烷(H2FCCFH2)時,扭轉構象比反構象更穩定,這是相反於大部分的1,2-二取代乙烷類通常會被預期到和觀察到;此現象稱為扭轉效應(gauche effect) [9]。1,2-二氟乙烷,該扭轉構象比反構象更穩定,在氣相中,更穩定2.4至3.4千焦/摩。這種效果不是指會出現在氟鹵素,然而;扭轉效應也可以在1,2-二甲氧基乙烷觀察到。一個相關的效果是烯烴順式作用。例如,1,2-二氟乙烯的順式異構體比反式異構體穩定。[10]

這裡有兩個主要影響扭轉效應的解釋:超共軛和彎曲的鍵結。在超共軛的模型,從碳-氫σ鍵軌道到碳-氟σ*反鍵軌道的電子密度的捐贈被認為是穩定扭轉異構體的來源。由於氟更電負,碳-氫σ軌道比碳氟σ軌道是更好的電子供體,而碳-氟σ*軌道比碳-氫σ*軌道為一個更好的電子受體。只有扭轉構象允許在更好的供體和受體之間的良好重疊。
在二氟乙烷扭轉效應的彎曲鍵關鍵解釋是,在兩個碳-氟鍵增加p軌域,由於氟的電負性大。其結果是電子密度建立在中央碳-碳鍵的上方、下方、左側和右側。由此此結果可以減少軌道重疊,當一個扭轉效應被假設,形成一個彎曲的鍵。在這兩種模式,超共軛通常被認為是二氟乙烷的扭轉效應的主因。[1][11]
光譜分析
[编辑]碳-氟鍵在紅外光譜的1000至1360cm⁻¹間伸縮。拉伸頻率對分子其他取代基敏感,出現範圍很闊。單氟化物在1000和1110cm⁻¹間有強頻帶;氟原子超過一粒,頻帶分成兩條,一條用於對稱模式,一條用於不對稱[12],碳-氟帶非常強,可掩蓋任何碳-氫帶[13]。
有機氟化合物也可用碳13、氟19(氟的唯一天然同位素)或氫1(如有)NMR光譜表徵。取決於取代度和官能團,氟十九NMR中的化學位移有很闊的範圍。下表顯示一些主要類別的範圍。[14]
化合物類型 化學位移範圍(ppm)(與CFCl3比較) F–C=O −70至−20 CF3 +40至+80 CF2 +80至+140 CF +140至+250 ArF +80至+170
參見
[编辑]參考文獻
[编辑]- ^ 1.0 1.1 1.2 O'Hagan D. Understanding organofluorine chemistry. An introduction to the C–F bond. Chem Soc Rev. February 2008, 37 (2): 308–19. PMID 18197347. doi:10.1039/b711844a.
- ^ 2.0 2.1 Lemal DM. "Perspective on Fluorocarbon Chemistry" (页面存档备份,存于互联网档案馆) J Org Chem. 2004, volume 69, p 1–11. doi:10.1021/jo0302556
- ^ Blanksby SJ, Ellison GB. Bond dissociation energies of organic molecules. Acc. Chem. Res. April 2003, 36 (4): 255–63. PMID 12693923. doi:10.1021/ar020230d.
- ^ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
- ^ Gillespie, Ronald, and Edward Robinson. 1992 Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine. Inorganic Chemistry, 31, 1960-1963.
- ^ Robinson, Edward, Samuel Johnson, Ting-Hua Tang, and Ronald Gillespie. 1997. Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model. Inorganic Chemistry, 36, 3022-3030.
- ^ Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán and Santiago Alvarez. Covalent radii revisited. Dalton Trans., 2008, 2832-2838, doi:10.1039/b801115j
- ^ P. Pyykkö, M. Atsumi, Chem. Eur. J., 15, 2009,186-197 doi:10.1002/chem.200800987.
- ^ Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser J. Am. Chem. Soc.; 1997; 119(20) pp 4789 - 4790; (Communication) doi:10.1021/ja963819e
- ^ The stereochemical consequences of electron delocalization in extended .pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena Richard C. Bingham J. Am. Chem. Soc.; 1976; 98(2); 535-540 Abstract (页面存档备份,存于互联网档案馆)
- ^ Goodman, L.; Gu, H.; Pophristic, V.. Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion. J. Phys. Chem. A. 2005, 109, 1223-1229. doi:10.1021/jp046290d
- ^ George Socrates, Socrates. Infrared and Raman characteristic group frequencies: tables and charts. John Wiley and Sons. 2001: 198. ISBN 0-470-09307-2.
- ^ Barbara H. Stuart. Infrared Spectroscopy: Fundamentals and Applications. John Wiley and Sons. 2004: 82. ISBN 0-470-85428-6.
- ^ 存档副本. [2008-11-09]. (原始内容存档于2008-05-15).
