聯氨:修订间差异
无编辑摘要 |
无编辑摘要 |
||
| (未显示10个用户的15个中间版本) | |||
| 第2行: | 第2行: | ||
{{Chembox |
{{Chembox |
||
| Name = 聯氨 |
| Name = 聯氨 |
||
| ImageFile1 = Hydrazine-distances-2D. |
| ImageFile1 = Hydrazine-distances-2D.svg |
||
| ImageSize1 = 150px |
| ImageSize1 = 150px |
||
| ImageFileR2 = Hydrazine-3D-balls.png |
| ImageFileR2 = Hydrazine-3D-balls.png |
||
| 第8行: | 第8行: | ||
| ImageFileL2 = Hydrazine-3D-vdW.png |
| ImageFileL2 = Hydrazine-3D-vdW.png |
||
| ImageSizeL2 = 120px |
| ImageSizeL2 = 120px |
||
| |
| ImageFileL3 = Sample of hydrazine hydrate.jpg |
||
| ImageFile3 = Anhydrous_hydrazine.png |
|||
| ImageCaption3 = 聯氨 |
|||
| IUPACName = Hydrazine |
|||
| |
| SystematicName = Diazane |
||
| |
| SystematicNameZh = 二氮烷 |
||
| OtherNames = 聯胺<br>肼 |
|||
| Section1 = {{Chembox Identifiers |
| Section1 = {{Chembox Identifiers |
||
| CASNo = 302-01-2 |
| CASNo = 302-01-2 |
||
| 第39行: | 第40行: | ||
| MolarMass = 32.05(无水)<BR>50.06(水合) |
| MolarMass = 32.05(无水)<BR>50.06(水合) |
||
| Appearance = 无色液体 |
| Appearance = 无色液体 |
||
| Density = 1.004 g/mL(无水)<BR>1.032 g/mL(一水) |
| Density = 1.004 g/mL(无水)<BR>1.146 g/mL(无水,−5 °C)<ref>Beck, G. Volume relationships of carbohydrates, amino acids, and hydrocarbons. ''Wiener Chemiker-Zeitung'', 1943. 46: 18-22. ISSN: 0372-7270.</ref><br>1.032 g/mL(一水) |
||
| Solubility = 混溶 |
| Solubility = 混溶 |
||
| MeltingPt = 2.0℃(无水)<BR>-51.5℃(一水) |
| MeltingPt = 2.0℃(无水)<BR>-51.5℃(一水) |
||
| 第63行: | 第64行: | ||
| Section8 = {{Chembox Related |
| Section8 = {{Chembox Related |
||
| Function = [[氢化物]] |
| Function = [[氢化物]] |
||
| OtherFunctn = [[过氧化氢]]、[[氨]] |
| OtherFunctn = [[过氧化氢]]、[[乙烷]]、 [[氨]]、[[聯膦]] |
||
| OtherCpds = [[甲基肼]]、[[二甲基肼]]<br/>[[苯肼]]、[[二硝基苯肼]] |
| OtherCpds = [[甲基肼]]、[[二甲基肼]]<br/>[[苯肼]]、[[二硝基苯肼]] |
||
}} |
}} |
||
}} |
}} |
||
'''聯氨''' |
'''聯氨'''({{lang-en|Hydrazine}}),又稱'''聯胺'''或'''(无水){{zy|肼|jǐng|ㄐㄧㄥˇ|粵音井}}''',分子式為N<sub>2</sub>H<sub>4</sub>,是無色的劇毒[[化合物]]。致死量為小鼠口服LD50为59mg/kg,静脉注射LD50为57mg/kg。其一水合物(N<sub>2</sub>H<sub>4</sub>·H<sub>2</sub>O)称作'''水合联氨'''或'''水合肼'''。 |
||
常態下呈無色油狀液體。氣味類似[[氨]],溶於水、醇、氨等溶劑,常用於[[人造衛星]]及[[火箭]]的[[燃料]]、[[鍋爐]]的[[抗腐蝕劑]]、[[炸藥]]與[[抗氧化劑]]等。 |
常態下呈無色油狀液體。氣味類似[[氨]],溶於水、醇、氨等溶劑,常用於[[人造衛星]]及[[火箭]]的[[燃料]]、[[鍋爐]]的[[抗腐蝕劑]]、[[炸藥]]與[[抗氧化劑]]等。 |
||
| 第101行: | 第102行: | ||
和NH<sub>3</sub>类似,联氨可以以分子的形式和一些金属化合物形成[[配合物]]。 |
和NH<sub>3</sub>类似,联氨可以以分子的形式和一些金属化合物形成[[配合物]]。 |
||
它可以在铜离子的催化下和过氧化氢反应:<ref>{{cite journal|journal=Journal of the American Chemical Society|volume=98|issue=7|language=en|issn=0002-7863|date=1976-03|pages=1683–1684|doi=10.1021/ja00423a008|url=http://pubs.acs.org/doi/abs/10.1021/ja00423a008|title=Kinetics of the oxidation of hydrazine by hydrogen peroxide, catalyzed by hydrated copper(II)|accessdate=2019-08-03|author=Carl R. Wellman, J. Richard Ward, Lester P. Kuhn}}</ref> |
它可以在铜离子的催化下和过氧化氢反应:<ref>{{cite journal|journal=Journal of the American Chemical Society|volume=98|issue=7|language=en|issn=0002-7863|date=1976-03|pages=1683–1684|doi=10.1021/ja00423a008|url=http://pubs.acs.org/doi/abs/10.1021/ja00423a008|title=Kinetics of the oxidation of hydrazine by hydrogen peroxide, catalyzed by hydrated copper(II)|accessdate=2019-08-03|author=Carl R. Wellman, J. Richard Ward, Lester P. Kuhn|archive-date=2021-04-21|archive-url=https://web.archive.org/web/20210421021727/https://pubs.acs.org/doi/abs/10.1021/ja00423a008}}</ref> |
||
: N<sub>2</sub>H<sub>4</sub> + 2 H<sub>2</sub>O<sub>2</sub> → N<sub>2</sub> + 4 H<sub>2</sub>O |
: N<sub>2</sub>H<sub>4</sub> + 2 H<sub>2</sub>O<sub>2</sub> → N<sub>2</sub> + 4 H<sub>2</sub>O |
||
| 第112行: | 第113行: | ||
在鹼性環境下可作為[[還原劑]]使用。 |
在鹼性環境下可作為[[還原劑]]使用。 |
||
:N<sub>2</sub>H<sub>4</sub> + 4OH<sup>-</sup> → N<sub>2</sub>↑ + 4H<sub>2</sub>O + 4e<sup>-</sup> ( |
:N<sub>2</sub>H<sub>4</sub> + 4OH<sup>-</sup> → N<sub>2</sub>↑ + 4H<sub>2</sub>O + 4e<sup>-</sup> (𝐸ᶱ = +1.16V) |
||
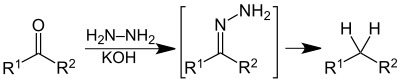
有機化學中,聯氨經常被作為還原試劑,以進行[[沃 |
有機化學中,聯氨經常被作為還原試劑,以進行[[沃尔夫-凯惜纳-黄鸣龙还原反应|沃-凱氏還原反應]]。 |
||
:[[File:Wolff-Kishner Summary V.1.svg|400px|沃-凱氏還原反應(Wolff–Kishner reduction)]] |
:[[File:Wolff-Kishner Summary V.1.svg|400px|沃-凱氏還原反應(Wolff–Kishner reduction)]] |
||
| 第138行: | 第139行: | ||
==外部連結== |
==外部連結== |
||
* [http://www.youtube.com/watch?v=5UFTfwTxeEk Lu Le Laboratory 聯氨與七氧化二錳之反應 420fps] |
* [http://www.youtube.com/watch?v=5UFTfwTxeEk Lu Le Laboratory 聯氨與七氧化二錳之反應 420fps] {{Wayback|url=http://www.youtube.com/watch?v=5UFTfwTxeEk |date=20151126091040 }} |
||
* [http://www.youtube.com/watch?v=SiE9gdieQbU Lu Le Laboratory 聯氨與七氧化二錳在半開放環境反應 420fps] |
* [http://www.youtube.com/watch?v=SiE9gdieQbU Lu Le Laboratory 聯氨與七氧化二錳在半開放環境反應 420fps] {{Wayback|url=http://www.youtube.com/watch?v=SiE9gdieQbU |date=20190716012651 }} |
||
{{Hydrazines}} |
{{Hydrazines}} |
||
2024年11月9日 (六) 12:08的最新版本
| 聯氨 | |||
|---|---|---|---|

| |||
| |||

| |||
| IUPAC名 Hydrazine | |||
| 系统名 Diazane 二氮烷 | |||
| 别名 | 聯胺 肼 | ||
| 识别 | |||
| CAS号 | 302-01-2 | ||
| PubChem | 9321 | ||
| ChemSpider | 8960 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | OAKJQQAXSVQMHS-UHFFFAOYAZ | ||
| Beilstein | 878137 | ||
| Gmelin | 190 | ||
| 3DMet | B00770 | ||
| UN编号 | 2029 | ||
| EINECS | 206-114-9 | ||
| ChEBI | 15571 | ||
| RTECS | MU7175000 | ||
| KEGG | C05361 | ||
| MeSH | Hydrazine | ||
| 性质 | |||
| 化学式 | N2H4(无水) N2H4·H2O(一水) | ||
| 摩尔质量 | 32.05(无水) 50.06(水合) g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
| 密度 | 1.004 g/mL(无水) 1.146 g/mL(无水,−5 °C)[1] 1.032 g/mL(一水) | ||
| 熔点 | 2.0℃(无水) -51.5℃(一水) | ||
| 沸点 | 113.5℃(无水) 120.1℃(一水,共沸) | ||
| 溶解性(水) | 混溶 | ||
| 黏度 | 0.9 cP, 25°C[2] | ||
| 结构 | |||
| 分子构型 | 氮原子为锥形 | ||
| 偶极矩 | 1.85 D[2] | ||
| 危险性 | |||
| 欧盟危险性符号 | |||
| 警示术语 | R:R45-R10-R23/24/25-R34-R43-R50/53 | ||
| 安全术语 | S:S53-S45-S60-S61 | ||
| MSDS | External MSDS | ||
GHS危险性符号    
| |||
| 主要危害 | 劇毒 | ||
| NFPA 704 | |||
| 闪点 | 38℃(无水,开杯) 75℃(一水,开杯) | ||
| 相关物质 | |||
| 相关氢化物 | 过氧化氢、乙烷、 氨、聯膦 | ||
| 相关化学品 | 甲基肼、二甲基肼 苯肼、二硝基苯肼 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
聯氨(英語:Hydrazine),又稱聯胺或(无水)
常態下呈無色油狀液體。氣味類似氨,溶於水、醇、氨等溶劑,常用於人造衛星及火箭的燃料、鍋爐的抗腐蝕劑、炸藥與抗氧化劑等。
联氨有吸湿性,在空气中发烟。燃烧會呈紫色火焰。液体中分子以二聚体存在。有强还原性和腐蚀性,能侵蚀玻璃、橡胶、皮革、软木等。
製取
[编辑]- NaClO + 2NH3 → N2H4 + NaCl + H2O
还可由氨、丙酮的混合物与氯气反应的产物水解制取,同时得到联氨和丙酮:
- 4NH3 + (CH3)2CO +Cl2 → (CH3)2C(N2H2) + 2NH4Cl+H2O
- (CH3)2C(N2H2) + H2O → (CH3)2CO + N2H4
性质
[编辑]结构
[编辑]聯氨的結構是從一對氨分子裡各取一個氫原子然後把他們結合起來,每一個H2N-N次單元是個金字塔。H-N-H角为108°,N-N鍵距離1.45Å。按照联氨偶极矩为1.85D及N-H键矩为4.44(10-30Cm)[3]计算得到偏转角为0.5°,分子符合重叠构象,近似C2v点群。也有认为分子符合偏轉構象[4][5]。旋扭難度是乙醇的兩倍,結構特性像过氧化氢。
化学性质
[编辑]聯氨的碱性仅为氨的15分之一。
- N2H4 + H+ → [N2H5]+
K = 8.5 x 10-7
(氨之K值 = 1.78 x 10-5)
成盐:[6]
- [N2H5]+ + H+ → [N2H6]2+
K = 8.4 x 10-16
但需注意的是,[N2H6]2+完全水解,因此这个离子很难存在于水溶液中:[7]
- [N2H6]2+ + H2O → N2H5+ + H3O+
联氨可以和二氧化碳反应:
- N2H4 + CO2 → N2H3COOH
和NH3类似,联氨可以以分子的形式和一些金属化合物形成配合物。
它可以在铜离子的催化下和过氧化氢反应:[8]
- N2H4 + 2 H2O2 → N2 + 4 H2O
用途
[编辑]與四氧化二氮混合使用可當作火箭的燃料。但通常会作为姿态控制火箭的单组元推进剂,在离开喷口前经过催化剂产生自燃。
- N2O4 + 2N2H4 → 3N2 ↑ + 4H2O
压水式核电机组启动时,會向一迴路冷却剂中注入联氨以除去水中的氧。
- N2H4+ O2 → 2H2O + N2↑
在鹼性環境下可作為還原劑使用。
- N2H4 + 4OH- → N2↑ + 4H2O + 4e- (𝐸ᶱ = +1.16V)
有機化學中,聯氨經常被作為還原試劑,以進行沃-凱氏還原反應。
绝大部分情况下,联氨可被水合联氨代替使用,以降低其危险性。
危险性
[编辑]对人健康的危害
[编辑]吸入本品蒸汽、刺激鼻和上呼吸道。此外,尚可出现头晕、恶心、呕吐、和中枢神经系统症状。液体或蒸汽对眼有刺激作用,可致眼的永久性损害。对皮肤有刺激性,可造成严重灼伤。可经皮肤吸收引起中毒,可致皮炎。口服引起头晕、恶心,以后出现暂时性中枢性呼吸抑制、心律紊乱,及中枢神经系统症状,如嗜睡、运动障碍、共济失调、麻木等,肝功能可出现异常。长期接触可出现神经衰弱综合征,肝大及肝功能异常。
化学活性
[编辑]遇明火、高热可燃。具有强还原性。与氧化剂能发生强烈反应,引起燃烧或爆炸。遇氧化汞、金属钠、氯化亚锡、2,4-二硝基氯苯剧烈反应。
前蘇聯有次失敗爆炸的火箭試射是將硝酸與聯胺作為火箭發動機的燃料,好處是不用經過點火程序,兩相混合即會自燃,簡單易用失敗率低,因此受到早期太空科技領域的歡迎。因為其自燃,高腐蝕,劇毒特性,只要發射失敗就會嚴重汙染發射場土地,即便成功發射也會污染大氣。目前已逐漸被相對環保的火箭燃料(液態氫氧,煤油等)取代而淘汰,目前多用於地球軌道衛星與外太空探測器使用(免點火裝置推進劑),因為外太空使用沒有環保汙染顧慮。
环境危害
[编辑]对环境有危害,对水体可造成污染。
注釋
[编辑]參考資料
[编辑]- ^ Beck, G. Volume relationships of carbohydrates, amino acids, and hydrocarbons. Wiener Chemiker-Zeitung, 1943. 46: 18-22. ISSN: 0372-7270.
- ^ 2.0 2.1 "Chemistry of the Elements", 2nd ed., Greenwood, N. N. and Earnshaw, A., Butterworth-Heinemann, Oxford (1997).
- ^ 周公度、段连运《结构化学基础第4版》,北京大学出版社(2008.01). ISBN 978-7-301-05773-5.
- ^ 宋天佑、徐家宁、程功臻、史苏华 《无机化学第二版》下册,高等教育出版社(2010.4). ISBN 978-7-04-028479-9.
- ^ Miessler, Gary L. and Tarr, Donald A. Inorganic Chemistry, Third Edition. Pearson Prentice Hall (2004). ISBN 0-13-035471-6.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ K. C. Patil. Inorganic Hydrazine Derivatives - Synthesis, Properties and Applications. Wiley, 2014: pp 2-3
- ^ Carl R. Wellman, J. Richard Ward, Lester P. Kuhn. Kinetics of the oxidation of hydrazine by hydrogen peroxide, catalyzed by hydrated copper(II). Journal of the American Chemical Society. 1976-03, 98 (7): 1683–1684 [2019-08-03]. ISSN 0002-7863. doi:10.1021/ja00423a008. (原始内容存档于2021-04-21) (英语).