水分解:修订间差异
外观
删除的内容 添加的内容
內容擴充 ,增加或調整分類 |
Skarowland(留言 | 贡献) 小 調整格式、排版 |
||
| 第13行: | 第13行: | ||
詳細作法如下: |
詳細作法如下: |
||
'''放置一玻璃瓶,搓兩個洞並放入兩個導電體,上方放置收集容器,等待一陣子後,裡面看起來會是空的,此時上方的⅔將會是氫氣,下方剩餘的⅓將是氧氣(因2 H<sub>2</sub>O → 2 H<sub>2</sub> + O<sub>2</sub><sub>,所以氫氣:氧氣=2:1,而氫氣密度較氧氣小,所以會在上)</sub>'''{{小作品}} |
|||
{{小作品}} |
|||
[[Category:環境化學]] |
[[Category:環境化學]] |
||
[[Category:燃料]] |
[[Category:燃料]] |
||
2024年8月25日 (日) 03:22的版本
此條目没有列出任何参考或来源。 (2020年7月14日) |
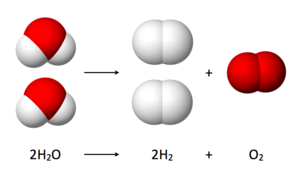
水分解(英語:water splitting)是將水分解為氧氣和氫氣的化學反應:
- 2 H2O → 2 H2 + O2
具效率性和經濟性的光化學水分解將是帶動氫經濟發展的技術性突破。目前尚無工業級純水分解應用,但兩個子反應(氫氣製造和氧氣製造)相對成熟。工業上,海水或鹽水分解主要用於生產氯氣;然而,其製程餘氫約佔全球氫氣供應之5%。光合作用亦可進行水分解,但不會產出氫氣。水分解之逆反應是氫燃料電池的基礎。
分解
在分解的過程中,最簡單的方式是將水通電
2 H2O + e- → 2 H2 + O2
詳細作法如下:
放置一玻璃瓶,搓兩個洞並放入兩個導電體,上方放置收集容器,等待一陣子後,裡面看起來會是空的,此時上方的⅔將會是氫氣,下方剩餘的⅓將是氧氣(因2 H2O → 2 H2 + O2,所以氫氣:氧氣=2:1,而氫氣密度較氧氣小,所以會在上)
| 这是一篇小作品。您可以通过编辑或修订扩充其内容。 |
