鈉鉀泵:修订间差异
小 機器人 修改: fr:Pompe sodium-potassium; 細部更改 |
|||
| 第34行: | 第34行: | ||
=== 外生(Exopenous) === |
=== 外生(Exopenous) === |
||
鈉鉀幫浦可被藥物做修飾。例如,心臟細胞膜上的鈉鉀幫浦是強心甙類(cardiac glycosides)藥物(如地高辛(digoxin)及ouabain)的重要作用目標,藉由增強收縮力來促進心臟表現。 |
鈉鉀幫浦可被藥物做修飾。例如,心臟細胞膜上的鈉鉀幫浦是[[強心甙類]](cardiac glycosides)藥物(如[[地高辛]](digoxin)及ouabain)的重要作用目標,藉由增強收縮力來促進心臟表現。 |
||
== 發現 == |
== 發現 == |
||
2010年3月5日 (五) 17:33的版本
鈉鉀幫浦(也可稱為鈉鉀-ATPase, Na+/K+-ATPase)是一種位於細胞膜上的酵素(EC 3.6.3.9),可在人類細胞及後生動物(metazoa)中發現。
鈉鉀幫浦
鈉鉀幫浦可以將細胞內相對高濃度的鉀離子送進細胞,並將相對低濃度的鈉離子送出細胞。經由以具放射性的鈉鉀離子標定,可以發現鈉鉀離子都會經過這個通道,鈉鉀離子的濃度在細胞膜兩側也都是相互依賴的,所以顯示了鈉鉀離子都可以經過這個載體運輸。目前已知鈉鉀幫浦需消耗ATP,並可以將三個鈉離子送出細胞,同時將兩個鉀離子送進細胞。
鈉鉀幫浦在1950年被丹麥的科學家Jens Skou發現,它代表了我們對離子進出細胞的認識的一個重要的里程碑。它也在細胞刺激上有著重要的意義,像神經細胞的刺激傳輸,就是用鈉鉀幫浦幫助維持細胞電位使神經衝動得以傳輸。
功能
鈉鉀幫浦可以幫忙維持細胞保持在靜止電位,幫助傳輸和調整細胞體積。他也有信號感應和整合的功能,和細胞內的鈣離子一樣幫助調整MAPK途徑、ROS。
靜止電位
為了維持細胞的電位,細胞內必須保持低濃度的鈉離子和高濃度的鉀離子。當細胞再極化時,細胞會打開鉀離子通道而使細胞的內的鉀離子經由鉀離子通道離開細胞,使細胞內的電位越來越低到達靜止電位。但當鉀離子通道太晚關閉時,細胞內的電位就會過低,而形成了過極化的現象。為了回復適當的電位,鈉鉀幫浦經由水解ATP獲得能量以主動運輸將三個鈉離子送出細胞,同時將兩個鉀離子送進細胞。最後細胞回復到靜止電位而可以準備開始下一個動作電位。但有一點不要弄錯,動作電位的產生跟鈉鉀幫浦並沒有直接的關係。
控制細胞體積
鈉鉀幫浦的重要功能之一就是維持細胞體積,機制如下所述。在細胞內部有大量無法分泌至細胞外的物質,如蛋白質及胞器等,這些物質造成滲透壓的差距,而使水由細胞外流入細胞內,若無調控則會導致細胞膨脹,甚至破裂。鈉鉀幫浦可避免此情況。幫浦將3個鈉離子運出細胞,並運入2個鉀離子。由於鈉離子對膜的穿透性比鉀離子差(鈉的水合半徑比鉀大),因此讓鈉離子傾向留於細胞外,而造成細胞不斷地流失離子,如此一來,產生相反的滲透壓梯度,使水分子滲出細胞外。所以,一但細胞有開始膨脹的現象,就會自動活化鈉鉀幫浦將離子運出細胞外。
訊息轉換子
在過去這些年中,許多實驗室證明了這些膜蛋白除了可以做傳統的離子運輸外,亦可藉由調控蛋白質上酪胺酸(tyrosine)的磷酸化(phosphorylation)來結合細胞間的ouabain傳遞訊息進入細胞內。藉由ouabain來觸發蛋白質磷酸化產生的下游訊息包括MAPK(mitogen-activated protein kinase)訊息的梯瀑效應(cascade)的活化、ROS的產生、PLC(phospholipase C)及IP3R(inositol triphosphate receptor) 的活化。[1]
蛋白質交互作用(protein-protein interaction)對鈉鉀幫浦媒介的訊息傳遞是很重要的,如:鈉鉀幫浦與無接收子酪胺酸磷酸酶(Src, a non-receptor tyrosine kinase)結合形成接收子複合物(receptor complex)。[2]鈉鉀幫浦亦會與ankyrin、IP3R、PI3K、PLC-gamma及cofilin結合。[3]
機制
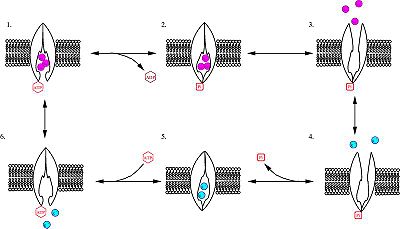
- ·幫浦接上ATP,並接上3的細胞內的鈉離子。
- ·藉由將ATP水解成ADP,使幫浦上高度保守的天冬胺酸片段(highly conserved aspartate residue)被磷酸化(phosphorylation)。
- ·磷酸化的幫浦構形改變(conformational change),對鈉離子的親和力(affinity)降低,而將鈉離子釋放至細胞外。
- ·幫浦接上2個細胞外的鉀離子。此舉造成幫浦去磷酸化(dephosphorylation),回復至原先構形,運送鉀離子進入細胞內。
- ·無磷酸化的幫浦構形對鈉離子的親和力高於鉀離子,因此2個鉀離子離開幫浦,ATP接上,過程變重新開始。
調節
內生(Endogenous)
鈉鉀幫浦被認為可由cAMP來調降。[4]若物質造成cAMP濃度上升,則鈉鉀幫浦濃度下降;反之,若cAMP濃度下降,則納鉀幫浦濃度上升。
外生(Exopenous)
鈉鉀幫浦可被藥物做修飾。例如,心臟細胞膜上的鈉鉀幫浦是強心甙類(cardiac glycosides)藥物(如地高辛(digoxin)及ouabain)的重要作用目標,藉由增強收縮力來促進心臟表現。
發現
Jens Christian Skou在1957年發現鈉鉀幫浦[5],並在1997年獲得諾貝爾化學獎。"for the first discovery of an ion-transporting enzyme, Na+, K+ -ATPase." [6]
基因
Alpha:ATP1A1[1], ATP1A2[2], ATP1A3[3], ATP1A4[4]
Beta:ATP1B1[5], ATP1B2, ATP1B3[6], ATP1B4
鈉-鉀-氯共轉運蛋白Na-K-Cl cotransporter(NKCC)
鈉-鉀-氯共轉運蛋白是一幫助鈉、鉀、氯進行主動運輸進出細胞的蛋白質。[7]此轉運膜蛋白有兩種變化或等形(isoforms),稱NKCC1或NKCC2。NKCC1廣泛地分佈遍及全身;其在分泌液體的器官中具有重要的功能。NKCC2特別出現在腎臟裡,在此處其從尿中萃取納、鉀、氯使得他們可以被重新再吸收回到血液中。
功能
NKCC蛋白是轉運膜蛋白,運輸鈉、鉀、氯穿過細胞膜。因為此蛋白移動每一溶質往相同方向,所以NKCC蛋白被視為同向運輸蛋白(symporters)。他們藉著轉移兩個帶正電的溶質(鈉跟鉀)併載著兩個帶負電的溶質(氯)維持電中性。因此NKCC蛋白的化學劑量為1Na:1K:2Cl。
動力學
運輸溶質穿越細胞膜所需能量是由鈉的電化學梯度所提供。鈉的電化學梯度是由鈉-鉀三磷酸腺苷酶(Na-K ATPase)所建立,鈉-鉀三磷酸腺苷酶是一需要消耗ATP的酵素。由於NKCC蛋白利用鈉的濃度梯度,則他們的活性間接的取決於ATP;所以NKCC蛋白被認為藉由主動運輸來移動溶質。
參考資料
- ^ Na/K-ATPase Tethers Phospholipase C and IP3 Receptor into a Calcium-regulatory Complex by Zhaokan Yuan, Ting Cai, Jiang Tian, Alexander V. Ivanov, David R. Giovannucci, and Zijian Xie in Molecular Biology of the Cell (2005) volume 16, pages 4034-4045.
- ^ Binding of Src to Na+/K+-ATPase Forms a Functional Signaling Complex by Jiang Tian, Ting Cai, Zhaokan Yuan, Haojie Wang, Lijun Liu, Michael Haas, Elena Maksimova,‡ Xin-Yun Huang and Zi-Jian Xie in Molecular Biology of the Cell (2005) volume 17, pages 317-326.
- ^ Interaction of the alpha subunit of Na,K-ATPase with cofilin by K. Lee, J. Jung, M. Kim and G. Guidotti in The Biochemical Journal (2001) volume 353, pages 377–385.
- ^ Regulation of Na+-K+-ATPase by cAMP-dependent protein kinase anchored on membrane via its anchoring protein Kinji Kurihara, Nobuo Nakanishi, and Takao Ueha. Departments of 1 Oral Physiology and 2 Biochemistry, School of Dentistry, Meikai University, Sakado, Saitama 350-0283, Japan
- ^ Skou J. The influence of some cations on an adenosine triphosphatase from peripheral nerves.. Biochim Biophys Acta. 1957, 23 (2): 394–401. PMID 13412736. doi:10.1016/0006-3002(57)90343-8.
- ^ Chemistry 1997
- ^ Haas M. The Na-K-Cl cotransporters. The American journal of physiology. 1994, 267 (4 Pt 1): C869–85. PMID 7943281. 已忽略未知参数
|month=(建议使用|date=) (帮助)

