MPV还原反应:修订间差异
外观
删除的内容 添加的内容
Symplectopedia(留言 | 贡献) 小 取消114.93.76.195 (对话)的编辑;更改回Choij的最后一个版本 |
|||
| 第45行: | 第45行: | ||
==反应机理== |
==反应机理== |
||
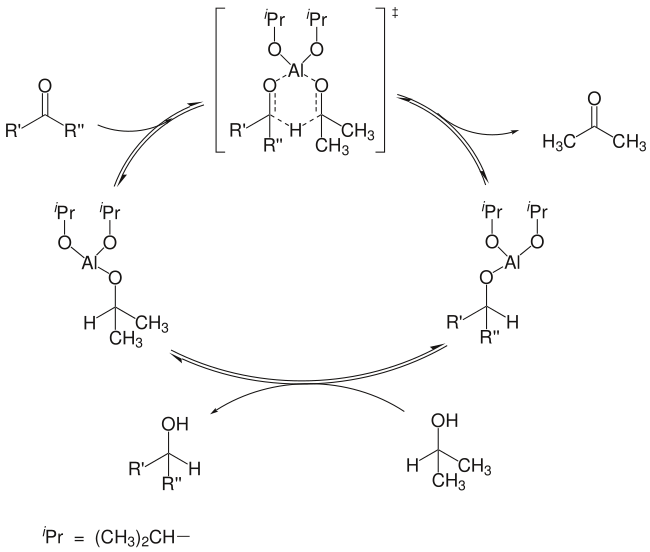
首先醛或酮的氧原子与作为 [[路易斯酸|Lewis 酸]]的铝原子配位,经六元环过渡态,异丙醇铝的 α-负氢转移到醛酮的羰基上,一方面,异丙醇基负离子被氧化为丙酮;另一方面,醛酮被还原为烷氧负离子,它与异丙醇进行负离子交换,生成相应的醇,同时形成一分子异丙醇铝 |
首先醛或酮的氧原子与作为 [[路易斯酸|Lewis 酸]]的铝原子配位,经六元环过渡态,异丙醇铝的 α-负氢转移到醛酮的羰基上,一方面,异丙醇基负离子被氧化为丙酮;另一方面,醛酮被还原为烷氧负离子,它与异丙醇进行负离子交换,生成相应的醇,同时形成一分子异丙醇铝。<ref>{{cite journal en |
||
| title = Mechanism of the Meerwein–Ponndorf Reduction |
| title = Mechanism of the Meerwein–Ponndorf Reduction |
||
| author = L. M. Jackman; J. A. Mills |
| author = L. M. Jackman; J. A. Mills |
||
| 第54行: | 第54行: | ||
| year = 1949 |
| year = 1949 |
||
| url = |
| url = |
||
| doi = 10.1038/164789a0 }}</ref> 因此,在这里异丙醇实际上是负氢源,而异丙醇铝是催化剂,理论上只需催化量即可完成反应。在实际中,为了提高反应速度和产率,常加入大于化学计量的异丙醇铝 |
| doi = 10.1038/164789a0 }}</ref> 因此,在这里异丙醇实际上是负氢源,而异丙醇铝是催化剂,理论上只需催化量即可完成反应。在实际中,为了提高反应速度和产率,常加入大于化学计量的异丙醇铝。 |
||
<br /> |
<br /> |
||
2010年8月20日 (五) 11:48的版本
Meerwein–Ponndorf–Verley还原反应(密尔温-彭杜夫-魏雷还原反应;梅尔魏因-庞多夫-维尔来还原反应),又称 Meerwein–Ponndorf还原反应(麦尔外因-彭杜尔夫还原反应),简称 MPV 还原
醛和酮 (1)等羰基化合物与异丙醇铝 (2)在异丙醇中的溶液共热时,醛酮被还原为相应的醇 (3),同时将异丙醇氧化为丙酮,生成的丙酮从平衡混合物中缓慢蒸出,使反应向右进行。[1][2][3][4][5][6]
这个反应相当于 Oppenauer氧化反应的逆向反应。反应有选择性好、条件温和、操作简便等优点,其他一些容易被还原的原子团不受这个方法的影响,例如碳-碳双键(包括位于羰基 α,β-位的)、羧酸酯、硝基和活泼的卤素(有例外)不为这种方法所还原。
反应机理
首先醛或酮的氧原子与作为 Lewis 酸的铝原子配位,经六元环过渡态,异丙醇铝的 α-负氢转移到醛酮的羰基上,一方面,异丙醇基负离子被氧化为丙酮;另一方面,醛酮被还原为烷氧负离子,它与异丙醇进行负离子交换,生成相应的醇,同时形成一分子异丙醇铝。[7] 因此,在这里异丙醇实际上是负氢源,而异丙醇铝是催化剂,理论上只需催化量即可完成反应。在实际中,为了提高反应速度和产率,常加入大于化学计量的异丙醇铝。
应用
2、生产氯霉素时的中间体发生反应时,只有羰基被还原为二级醇,而苯环上的硝基保持不变。[8]
2、对氯苯甲醛经过还原得到对氯苯甲醇,产率92%,卤素不受影响。
参见
参考资料
- ^ Hans Meerwein,. Über die Reduzierende Wirkung der Metallalkyle, insbesondere der Aluminium- und Bor-alkyle. J. Prakt. Chem. 1936, 147: 24. doi:10.1002/prac.19361470608.doi:10.1002/prac.19361470607doi:10.1002/prac.19361470606
- ^ Hans Meerwein, Rudolf Schmidt. Ein neues Verfahren zur Reduktion von Aldehyden und Ketonen. Justus Liebigs Annalen der Chemie. 1924, 444 (1): 221–238. doi:10.1002/jlac.19254440112.
- ^ Wolfgang Ponndorf. Der reversible Austausch der Oxydationsstufen zwischen Aldehyden oder Ketonen einerseits und primären oder sekundären Alkoholen anderseits. Angewandte Chemie. 1926, 39 (5): 138–143. doi:10.1002/ange.19260390504.
- ^ Verley, A.,. Bull. Soc. Chim. Fr. 1925, 37: 537. 缺少或
|title=为空 (帮助) - ^ Alexander R. Surrey, Name Reactions in Organic Chemistry, 2nd Edition, Academic Press, 1961.
- ^ Kurti and Czako, Strategic Application of Named Reaction in Organic Synthesis, Elsevier Academic Press, 2005.
- ^ L. M. Jackman; J. A. Mills. Mechanism of the Meerwein–Ponndorf Reduction. Nature. 1949, 164: 789–790. doi:10.1038/164789a0.
- ^ Loren M. Long, H. D. Troutman. Chloramphenicol (Chloromycetin). VII. Synthesis through p-Nitroacetophenone. J. Am. Chem. Soc. 1949, 71 (7): 2473–2475. doi:10.1021/ja01175a068.
