高锰酸盐:修订间差异
外观
删除的内容 添加的内容
小 r2.7.1) (機器人 新增: id:Permanganat |
小 r2.7.2) (機器人 新增: pl:Nadmanganiany |
||
| 第62行: | 第62行: | ||
[[ja:過マンガン酸塩]] |
[[ja:過マンガン酸塩]] |
||
[[nl:Permanganaat]] |
[[nl:Permanganaat]] |
||
[[pl:Nadmanganiany]] |
|||
[[pt:Permanganato]] |
[[pt:Permanganato]] |
||
[[simple:Permanganate]] |
[[simple:Permanganate]] |
||
2011年12月30日 (五) 03:45的版本

高锰酸盐是高锰酸所形成的盐,含有四面体型的高锰酸根离子—MnO4−,其中锰的氧化态为+7,有强氧化性。高锰酸钾是最重要的高锰酸盐,为紫红色的针状晶体。
酸性溶液中,高锰酸根离子被还原为无色的Mn2+离子:
- 16 H3O+ + 2 MnO4− + 10 Cl− → 2 Mn2+ + 5 Cl2 + 24 H2O
- 6 H+ + 2 MnO4− + 5 HCOOH → 8 H2O + 2 Mn2+ + 5 CO2
碱性溶液中还原,既可得到棕色的MnO2(锰氧化态为+4),也可得到深绿色的MnO42−(锰氧化态为+6)。
- 4 OH− + 2 MnO4− + 3 C2O42− → 2 MnO2 + 6 CO32− + 2 H2O
- 3 OH− + 2 MnO4− + HSO3− → 2 MnO42− + SO42− + 2 H2O
生产
高锰酸盐可由锰化合物被强氧化剂氧化得到。可用的氧化剂如次氯酸钠、二氧化铅、高碘酸等:
- 2 MnCl2 + 5 NaClO + 6 NaOH → 2 NaMnO4 + 9 NaCl+ 3 H2O
- 2 MnSO4 + 5 PbO2+ 3 H2SO4 → 2 HMnO4+ 5 PbSO4 + 2 H2O
工业上制取高锰酸钾时,是用氯酸钾作氧化剂与二氧化锰共熔,使其转化为锰酸钾,然后用氯气氧化得到。
性质
高锰酸盐类似于高氯酸盐,性质较稳定,有很强的氧化性,常用在分析化学的氧化还原滴定中。它与还原性物质及有机物质混合可能发生燃烧或爆炸。加热到230°C时,高锰酸钾分解为锰酸钾、二氧化锰和氧气,这也是初中演示氧气制备的常用反应之一:
高锰酸根离子不能和二价锰离子共存,是因为:
- 2MnO4-(aq) + 3Mn2+(aq) + 2H2O ↔ 5MnO2(S) + 4H+[1]
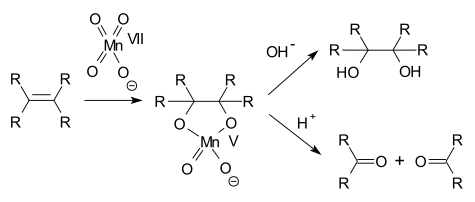
高锰酸盐(尤其是高锰酸钾)是有机合成中的氧化剂,它可以将胺氧化为相应的硝基化合物[2][3],将醇氧化为酮[4]或醛和羧酸[5][6],将其他烯烃氧化为邻二醇[7],以及将末端烯烃氧化为相应的羧酸[8]等。烯烃被高锰酸盐氧化的反应是通过一个环状的高锰酸酯机理进行的,碱性条件下的产物是二醇,酸性条件下则为两个酮,如下图所示。
化合物
参考资料
- ^ 高锰酸盐(法文):http://fr.wikipedia.org/wiki/Permanganate#Propri.C3.A9t.C3.A9s_oxydantes
- ^ OS 52:77 http://www.orgsynth.org/orgsyn/pdfs/CV6P0803.pdf
- ^ OS 43:87 http://www.orgsynth.org/orgsyn/pdfs/CV5P0845.pdf
- ^ OS 39:51 http://www.orgsynth.org/orgsyn/pdfs/CV4P0467.pdf
- ^ OS 10:82 http://www.orgsynth.org/orgsyn/pdfs/CV2P0538.pdf
- ^ OS 16:39 http://www.orgsynth.org/orgsyn/pdfs/CV2P0315.pdf
- ^ OS 11:52 http://www.orgsynth.org/orgsyn/pdfs/CV2P0307.pdf
- ^ OS 60:11 http://www.orgsynth.org/orgsyn/pdfs/CV7P0397.pdf
