親核共軛加成:修订间差异
无编辑摘要 |
|||
| 第1行: | 第1行: | ||
'''親核共軛加成'''是一種[[ |
'''親核共軛加成'''是一種[[有機反應]]。普通的[[親核加成]]或'''1,2-親核加成'''大部分的處理方式是增加[[羰基]]化合物。因為缺乏[[極性]],所以簡單的[[烯烃]]化合物不顯示1,2-親核的反應性,除非用特殊的[[取代基]]去激活烯烃。從[[羰基|α,β-不飽和羰基化合物]],如:[[環己烯酮]],可以推斷[[共振結構]]的β位在[[親電子]]部位,它可以與[[親核試劑]]做反應。在這些結構中的負電荷被存儲當作[[醇鹽]]陰離子,像這樣的親核加成反應被稱做親核[[共軛]]加成或'''1,4-親核加成'''。而最重要的活性烯烃是上述的共軛羰基和[[丙烯腈]]。 |
||
==反應機制== |
==反應機制== |
||
共軛加成是親核加成的[[插烯]](化合物的鍵結為單雙單雙)共軛。親核試劑與[[羰基|α,β-不飽和羰基化合物]]的β位置反應。親核試劑所帶負電荷因[[共振]]產生離域化的醇鹽陰離子和α碳原子[[負碳離子]]。質子通過[[酮-烯醇互变异构]]產生飽和羰基化合物。[[ |
共軛加成是親核加成的[[插烯]](化合物的鍵結為單雙單雙)共軛。親核試劑與[[羰基|α,β-不飽和羰基化合物]]的β位置反應。親核試劑所帶負電荷因[[共振]]產生離域化的醇鹽陰離子和α碳原子[[負碳離子]]。質子通過[[酮-烯醇互变异构]]產生飽和羰基化合物。[[相鄰兩個官能基]]的質子由另一個親電子取代 |
||
==反應== |
==反應== |
||
* 共軛羰基化合物與二級胺反應以形成1,4 - 酮胺。 |
* 共軛羰基化合物與二級胺反應以形成1,4 - 酮胺。 |
||
* 共軛羰基化合物與氰化氫反應產生1,4 - 酮醯基。在'''Nagata reaction'''的氰化物由[[ |
* 共軛羰基化合物與氰化氫反應產生1,4 - 酮醯基。在'''Nagata reaction'''的氰化物由[[二乙基氰化鋁]]而來。 |
||
* 吉爾曼試劑對1,4 - 共軛羰基來說是一種有效的親核試劑。 |
* 吉爾曼試劑對1,4 - 共軛羰基來說是一種有效的親核試劑。 |
||
* 邁克爾反應包括烯醇共軛羰基化合物的共軛加成。 |
* 邁克爾反應包括烯醇共軛羰基化合物的共軛加成。 |
||
| 第18行: | 第18行: | ||
一個不對稱合成的共軛加成例子,環己烯酮,苯硼酸,銠乙酰丙酮催化劑和掌性配體的BINAP合成(R)-3 - 苯基- 環己酮。 |
一個不對稱合成的共軛加成例子,環己烯酮,苯硼酸,銠乙酰丙酮催化劑和掌性配體的BINAP合成(R)-3 - 苯基- 環己酮。 |
||
[[Image:(R)-3-phenyl-cyclohanone.gif|center|:(R)-3-phenyl-cyclohanone]] |
[[Image:(R)-3-phenyl-cyclohanone.gif|center|:(R)-3-phenyl-cyclohanone]] |
||
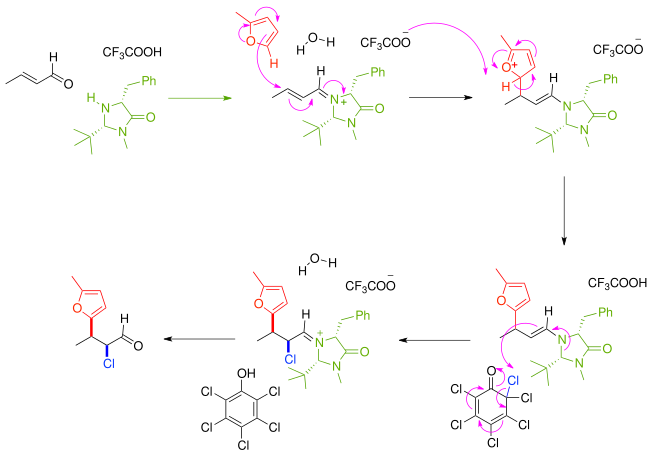
另一個不對稱合成的例子中,α,β-不飽和羰基化合物和掌性咪唑酮的催化劑及[[ |
另一個不對稱合成的例子中,α,β-不飽和羰基化合物和掌性咪唑酮的催化劑及[[掌性輔助劑]] 反應產生[[alkylimino-de-oxo-bisubstitution]]中的亞胺化合物,然後以鏡像選擇反應與[[furan]] 親核試劑反應。直接產生的反應物是一種親核的[[烯胺]]和從氯化苯[[醌]]而來的氯的級聯反應。胺催化劑去除後酮被有效地官能化親核試劑和親電子試劑[[順反]]比8:1和97%[[鏡像超度]](ee)。 |
||
[[Image:EnantioselectiveOrganoCascadeCatalysis.svg|center|Enantioselective Organo Cascade Catalysis]] |
[[Image:EnantioselectiveOrganoCascadeCatalysis.svg|center|Enantioselective Organo Cascade Catalysis]] |
||
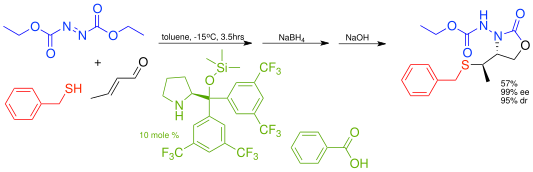
這一原則也適用於[[ |
這一原則也適用於[[多組]]的鏡像選擇性的親核共軛加成,例如苯甲基硫醇和親電[[偶氮二甲酸二乙酯]] |
||
[[Image:ConjugatedAdditionofThiols.svg|center|Enantioselective Conjugated Addition of Thiols to ,Unsaturated Aldehydes]] |
[[Image:ConjugatedAdditionofThiols.svg|center|Enantioselective Conjugated Addition of Thiols to ,Unsaturated Aldehydes]] |
||
| 第27行: | 第27行: | ||
==參見== |
==參見== |
||
*[[亲核抽象]] |
|||
[[:en:Nucleophilic abstraction|Nucleophilic abstraction]] |
|||
==參考文獻== |
==參考文獻== |
||
2013年2月3日 (日) 11:56的版本
親核共軛加成是一種有機反應。普通的親核加成或1,2-親核加成大部分的處理方式是增加羰基化合物。因為缺乏極性,所以簡單的烯烃化合物不顯示1,2-親核的反應性,除非用特殊的取代基去激活烯烃。從α,β-不飽和羰基化合物,如:環己烯酮,可以推斷共振結構的β位在親電子部位,它可以與親核試劑做反應。在這些結構中的負電荷被存儲當作醇鹽陰離子,像這樣的親核加成反應被稱做親核共軛加成或1,4-親核加成。而最重要的活性烯烃是上述的共軛羰基和丙烯腈。
反應機制
共軛加成是親核加成的插烯(化合物的鍵結為單雙單雙)共軛。親核試劑與α,β-不飽和羰基化合物的β位置反應。親核試劑所帶負電荷因共振產生離域化的醇鹽陰離子和α碳原子負碳離子。質子通過酮-烯醇互变异构產生飽和羰基化合物。相鄰兩個官能基的質子由另一個親電子取代
反應
- 共軛羰基化合物與二級胺反應以形成1,4 - 酮胺。
- 共軛羰基化合物與氰化氫反應產生1,4 - 酮醯基。在Nagata reaction的氰化物由二乙基氰化鋁而來。
- 吉爾曼試劑對1,4 - 共軛羰基來說是一種有效的親核試劑。
- 邁克爾反應包括烯醇共軛羰基化合物的共軛加成。
- 斯托克烯胺反應包含烯胺的共軛加成到羰基的共軛加成。
範圍
共軛加成反應在有機金屬的幫助之下會產生新的碳碳鍵上,例如甲基乙烯基酮和有機鋅碘化物反應。
![(4R',5R')-5-(5-Ethyl-2,2-dimethyl-[1,3]-dioxolan-4-yl) -pentan-2-one](/upwiki/wikipedia/commons/7/7b/Conjugateadditionexample.png)
一個不對稱合成的共軛加成例子,環己烯酮,苯硼酸,銠乙酰丙酮催化劑和掌性配體的BINAP合成(R)-3 - 苯基- 環己酮。
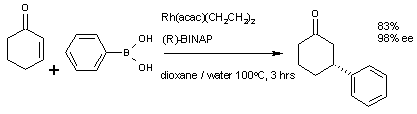
另一個不對稱合成的例子中,α,β-不飽和羰基化合物和掌性咪唑酮的催化劑及掌性輔助劑 反應產生alkylimino-de-oxo-bisubstitution中的亞胺化合物,然後以鏡像選擇反應與furan 親核試劑反應。直接產生的反應物是一種親核的烯胺和從氯化苯醌而來的氯的級聯反應。胺催化劑去除後酮被有效地官能化親核試劑和親電子試劑順反比8:1和97%鏡像超度(ee)。
這一原則也適用於多組的鏡像選擇性的親核共軛加成,例如苯甲基硫醇和親電偶氮二甲酸二乙酯
毒理學
可溶性的Michael受體是有毒的,因為他們由共軛加成使DNA烷基化。這樣的修改引起突變,這些突變會使細胞具毒性和致癌性。然而,穀胱甘肽也能夠與他們反應,例如用富馬酸二甲酯與之反應。
參見
參考文獻
- Conjugate addition
- ^ Andréa L. de Sousa and Inês S. Resck. Asymmetric Synthesis of exo-Isobrevicomin and exo-Brevicomin via Conjugated Addition of Primary Alkyl Iodides to α,β-Unsaturated Ketones. J. Braz. Chem. Soc. 2002, 13 (2): 233. doi:10.1590/S0103-50532002000200015.
- ^ Tamio Hayashi, Makoto Takahashi, Yoshiaki Takaya, and Masamichi Ogasawara (2004). "(R)-3-phenyl-cyclohexanone". Org. Synth.; Coll. Vol. 10: 609.
- ^ Huang, Y; Walji, AM; Larsen, CH; Macmillan, DW. Enantioselective Organo-Cascade Catalysis. J. Am. Chem. Soc. (Free full text). 2005, 127 (43): 15051–15053. ISSN 0002-7863. PMID 16248643. doi:10.1021/ja055545d. 已忽略未知参数
|month=(建议使用|date=) (帮助);|author=和|last1=只需其一 (帮助) - ^ Marigo, M; Schulte, T; Franzén, J; Jørgensen, KA. Asymmetric Multicomponent Domino Reactions and Highly Enantioselective Conjugated Addition of Thiols to α,β-Unsaturated Aldehydes. J. Am. Chem. Soc. 2005, 127 (45): 15710–15711. ISSN 0002-7863. PMID 16277506. doi:10.1021/ja055291w. 已忽略未知参数
|month=(建议使用|date=) (帮助);|author=和|last1=只需其一 (帮助)
