碳负离子:修订间差异
外观
删除的内容 添加的内容
小 增加或調整內部連結 |
小 增加或調整內部連結 |
||
| 第5行: | 第5行: | ||
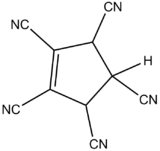
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。<ref>Frank A. Carey and Richard J. Sundberg, ''Advanced Organic Chemistry'', 4th ed., Kluwer Academic/Plenum Publishers, New York, 2000, ISBN 0-306-46243-5.</ref>这些基团可以是[[苯基]]、[[电负性]]较强的杂原子(如O,N,基团如[[硝基|-NO<sub>2</sub>]]、[[羰基|-C(=O)-]]、[[酯基|-CO<sub>2</sub>R]]、[[砜|-SO<sub>2</sub>-]]、[[氰基|-CN]]和[[酰胺|-CONR<sub>2</sub>]]等)或末端[[炔烃]](也可看作电负性的缘故),例如,[[三苯甲烷]]、[[三氰基甲烷]]、[[硝基甲烷]]和[[1,3-二羰基化合物]]具有较强的酸性。右图所示的分子pK值小于-11。<ref>Table 5.1 and 5.2 in J. R. Jones, ''The Ionization of Carbon Acids'', Academic Press, New York, 1973, pp. 64, 65.</ref> |
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。<ref>Frank A. Carey and Richard J. Sundberg, ''Advanced Organic Chemistry'', 4th ed., Kluwer Academic/Plenum Publishers, New York, 2000, ISBN 0-306-46243-5.</ref>这些基团可以是[[苯基]]、[[电负性]]较强的杂原子(如O,N,基团如[[硝基|-NO<sub>2</sub>]]、[[羰基|-C(=O)-]]、[[酯基|-CO<sub>2</sub>R]]、[[砜|-SO<sub>2</sub>-]]、[[氰基|-CN]]和[[酰胺|-CONR<sub>2</sub>]]等)或末端[[炔烃]](也可看作电负性的缘故),例如,[[三苯甲烷]]、[[三氰基甲烷]]、[[硝基甲烷]]和[[1,3-二羰基化合物]]具有较强的酸性。右图所示的分子pK值小于-11。<ref>Table 5.1 and 5.2 in J. R. Jones, ''The Ionization of Carbon Acids'', Academic Press, New York, 1973, pp. 64, 65.</ref> |
||
除此之外,不同于[[缩酮]],[[缩硫酮]]的[[α氢]]也具有较强的酸性。这可以用[[硫]]的 |
除此之外,不同于[[缩酮]],[[缩硫酮]]的[[α氢]]也具有较强的酸性。这可以用[[硫]]的3[[d轨道]]与C-S键[[σ*轨道|σ<sup>*</sup>轨道]]的[[超共轭效应]]来解释。<ref>W. T. Borden, E. R. Davidson, N. H. Andersen, A. D. Denniston, and N. D. Epiotis, [[:en:J. Am. Chem. Soc.|''J. Am. Chem. Soc.'']] '''100''':1604 (1978); A. Streitwieser, Jr., and S. P. Ewing, ''J. Am. Chem. Soc'' '''97''':190 (1975); N. D. Epiotis, R. L. Yates, F. Bernardi, and S. Wolfe, ''J. Am. Chem. Soc.'' '''98''':5435 (1976); J.-M. Lehn and G. Wipff, ''J. Am. Chem. Soc.'' '''98''':7498 (1976); D. A. Bors and A. Streitwieser, Jr., ''J. Am. Chem. Soc.'' '''108''':1097 (1986).</ref>硫代硝基苯基甲烷的[[去质子化]]表明,硫的[[可极化性]]起主要作用。<ref>C. F. Bernasconi and K. W. Kittredge, [[:en:J. Org. Chem.|''J. Org. Chem.'']] '''63''':1944 (1998).</ref> |
||
[[有机金属化合物]],如[[Grignard试剂]]和[[有机锂试剂]]也可看作是碳负离子源。[[叶立德]],如[[磷叶立德]]和[[硫叶立德]]等,都含有具有碳负离子结构的[[共振杂化体]]。 |
[[有机金属化合物]],如[[Grignard试剂]]和[[有机锂试剂]]也可看作是碳负离子源。[[叶立德]],如[[磷叶立德]]和[[硫叶立德]]等,都含有具有碳负离子结构的[[共振杂化体]]。 |
||
2013年6月30日 (日) 15:27的版本

碳负离子(Carbanion)指的是含有一个连有三个基团,并且带有一对孤对电子的碳的活性中间体。碳负离子带有一个单位负电荷,通常是四面体构型,其中孤对电子占一个 sp3 杂化轨道。通过比较相应酸的酸性大小,可以大致判断碳负离子的稳定性大小。
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。[1]这些基团可以是苯基、电负性较强的杂原子(如O,N,基团如-NO2、-C(=O)-、-CO2R、-SO2-、-CN和-CONR2等)或末端炔烃(也可看作电负性的缘故),例如,三苯甲烷、三氰基甲烷、硝基甲烷和1,3-二羰基化合物具有较强的酸性。右图所示的分子pK值小于-11。[2]
除此之外,不同于缩酮,缩硫酮的α氢也具有较强的酸性。这可以用硫的3d轨道与C-S键σ*轨道的超共轭效应来解释。[3]硫代硝基苯基甲烷的去质子化表明,硫的可极化性起主要作用。[4]
有机金属化合物,如Grignard试剂和有机锂试剂也可看作是碳负离子源。叶立德,如磷叶立德和硫叶立德等,都含有具有碳负离子结构的共振杂化体。
碳负离子可进行SN2反应。
参见
参考资料
- ^ Frank A. Carey and Richard J. Sundberg, Advanced Organic Chemistry, 4th ed., Kluwer Academic/Plenum Publishers, New York, 2000, ISBN 0-306-46243-5.
- ^ Table 5.1 and 5.2 in J. R. Jones, The Ionization of Carbon Acids, Academic Press, New York, 1973, pp. 64, 65.
- ^ W. T. Borden, E. R. Davidson, N. H. Andersen, A. D. Denniston, and N. D. Epiotis, J. Am. Chem. Soc. 100:1604 (1978); A. Streitwieser, Jr., and S. P. Ewing, J. Am. Chem. Soc 97:190 (1975); N. D. Epiotis, R. L. Yates, F. Bernardi, and S. Wolfe, J. Am. Chem. Soc. 98:5435 (1976); J.-M. Lehn and G. Wipff, J. Am. Chem. Soc. 98:7498 (1976); D. A. Bors and A. Streitwieser, Jr., J. Am. Chem. Soc. 108:1097 (1986).
- ^ C. F. Bernasconi and K. W. Kittredge, J. Org. Chem. 63:1944 (1998).
| 这是一篇與化学相關的小作品。您可以通过编辑或修订扩充其内容。 |
