親核共軛加成:修订间差异
CommonsDelinker(留言 | 贡献) |
小 (Script) Duplicate: File:(R)-3-phenyl-cyclohanone - 2.png → File:(R)-3-phenyl-cyclohanone.png Exact or scaled-down duplicate: commons::File:(R)-3-phenyl-cyclohanone.png |
||
| 第20行: | 第20行: | ||
[[Image:Conjugateadditionexample.gif|center|(4R',5R')-5-(5-Ethyl-2,2-dimethyl-[1,3]-dioxolan-4-yl) -pentan-2-one]] |
[[Image:Conjugateadditionexample.gif|center|(4R',5R')-5-(5-Ethyl-2,2-dimethyl-[1,3]-dioxolan-4-yl) -pentan-2-one]] |
||
以下是一個[[不对称合成]]的共軛加成例子:[[環己烯酮]]和[[苯基硼酸|苯硼酸]]反應,加上[[銠]][[乙酰丙酮]]催化劑及{{link-en|掌性配體|Chiral ligand}}的[[BINAP]],最後合成(R)-3-苯基-環己酮。 |
以下是一個[[不对称合成]]的共軛加成例子:[[環己烯酮]]和[[苯基硼酸|苯硼酸]]反應,加上[[銠]][[乙酰丙酮]]催化劑及{{link-en|掌性配體|Chiral ligand}}的[[BINAP]],最後合成(R)-3-苯基-環己酮。 |
||
[[Image:(R)-3-phenyl- |
[[Image:(R)-3-phenyl-cyclohanone.png|center|:(R)-3-phenyl-cyclohanone]] |
||
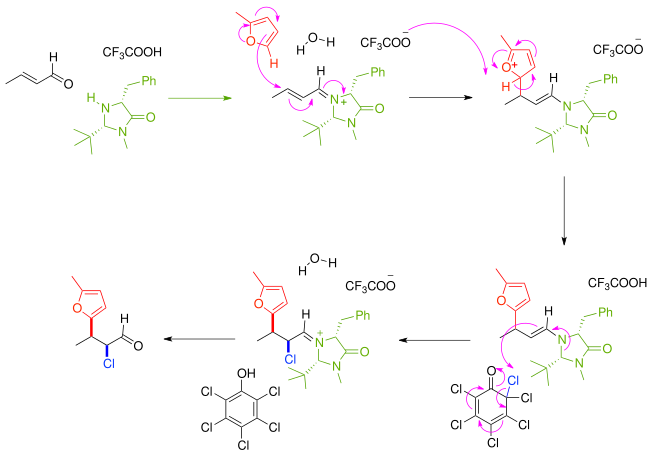
<!--unchceked-->另一個不對稱合成的例子:α,β-不飽和羰基化合物首先和掌性咪唑酮催化劑及{{link-en|掌性輔助劑|Chiral auxiliary}}反應產生{{link-en|胺羰缩合反应|alkylimino-de-oxo-bisubstitution}}中的[[亞胺]]化合物,然後以鏡像選擇與[[呋喃]]親核試劑反應。並會快速產生親核的[[烯胺]],接著形成從氯化苯[[醌]]而來的氯的級聯反應。在去除胺催化劑後,酮被親核試劑和親電子試劑[[順反]]比8:1和97%[[鏡像超度]](ee)有效地官能化。 |
<!--unchceked-->另一個不對稱合成的例子:α,β-不飽和羰基化合物首先和掌性咪唑酮催化劑及{{link-en|掌性輔助劑|Chiral auxiliary}}反應產生{{link-en|胺羰缩合反应|alkylimino-de-oxo-bisubstitution}}中的[[亞胺]]化合物,然後以鏡像選擇與[[呋喃]]親核試劑反應。並會快速產生親核的[[烯胺]],接著形成從氯化苯[[醌]]而來的氯的級聯反應。在去除胺催化劑後,酮被親核試劑和親電子試劑[[順反]]比8:1和97%[[鏡像超度]](ee)有效地官能化。 |
||
[[Image:EnantioselectiveOrganoCascadeCatalysis.svg|center|Enantioselective Organo Cascade Catalysis]] |
[[Image:EnantioselectiveOrganoCascadeCatalysis.svg|center|Enantioselective Organo Cascade Catalysis]] |
||
2014年6月17日 (二) 16:52的版本

親核共軛加成是一種有關共轭不飽和有機化合物的加成反應。一般羰基化合物的化成反應多半是一般的親核加成或1,2-親核加成反應。簡單的烯烃化合物由於缺乏極性,不會有1,2-親核加成的反應性,但若用特殊的取代基去激活烯烃,就會有反應性。
α,β-不飽和羰基化合物(像環己烯酮)可以由共振結構推斷β部位是親電子部位,可以與親核試劑反應。結構中有負電荷,會變成醇鹽陰離子,這樣的親核加成反應稱做親核共軛加成或1,4-親核加成。而最重要的活性烯烃是上述提到的共軛羰基和丙烯腈。
反應機制
共軛加成是符合插烯原則(化合物的鍵結為單雙單雙)的親核加成反應。親核試劑與α,β-不飽和羰基化合物的β位置反應。親核試劑所帶負電荷因離域化,在醇鹽陰離子和有α碳原子的碳负离子二組組態之間共振。质子化反應通過酮-烯醇互变异构產生飽和羰基化合物。相鄰兩個官能基的氫則由另一個親電試劑取代。
反應
- 共軛羰基化合物與二級胺反應以形成1,4-酮胺。
- 共軛羰基化合物與氰化氫反應產生1,4-酮醯基。在Nagata反應中,氰化物是由二乙基氰化鋁提供。
- 吉爾曼試劑是對1,4-共軛羰基有效的親核試劑。
- 麦克尔加成反应是烯醇的共軛加成,產物是羰基的共軛化合物。
- 施托克烯胺反应是烯胺的共軛加成,產物到羰基的共軛化合物。
範圍
此條目翻譯品質不佳。 (2013年2月23日) |
共軛加成反應在有機金屬試劑的幫助之下,是有效產生新的碳-碳鍵的方式,例如甲基乙烯基酮和有機鋅碘化物反應。
![(4R',5R')-5-(5-Ethyl-2,2-dimethyl-[1,3]-dioxolan-4-yl) -pentan-2-one](/upwiki/wikipedia/commons/7/7b/Conjugateadditionexample.png)
以下是一個不对称合成的共軛加成例子:環己烯酮和苯硼酸反應,加上銠乙酰丙酮催化劑及掌性配體的BINAP,最後合成(R)-3-苯基-環己酮。
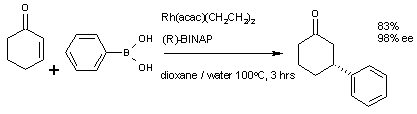
另一個不對稱合成的例子:α,β-不飽和羰基化合物首先和掌性咪唑酮催化劑及掌性輔助劑反應產生胺羰缩合反应中的亞胺化合物,然後以鏡像選擇與呋喃親核試劑反應。並會快速產生親核的烯胺,接著形成從氯化苯醌而來的氯的級聯反應。在去除胺催化劑後,酮被親核試劑和親電子試劑順反比8:1和97%鏡像超度(ee)有效地官能化。
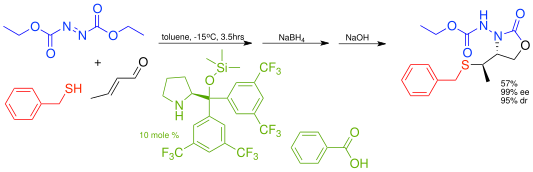
這一原則也適用於多組分反應鏡像選擇性的硫醇級聯親核共軛加成反應,例如苯甲基硫醇和親電性的偶氮二甲酸二乙酯反應。
毒理學
可溶性的Michael受體會利用共軛加成,使DNA烷基化引起突變,因此具有細胞毒性及致癌性。然而,穀胱甘肽及富馬酸二甲酯也能夠與Michael受體反應。
參見
參考文獻
- Conjugate addition
- ^ Andréa L. de Sousa and Inês S. Resck. Asymmetric Synthesis of exo-Isobrevicomin and exo-Brevicomin via Conjugated Addition of Primary Alkyl Iodides to α,β-Unsaturated Ketones. J. Braz. Chem. Soc. 2002, 13 (2): 233. doi:10.1590/S0103-50532002000200015.
- ^ Tamio Hayashi, Makoto Takahashi, Yoshiaki Takaya, and Masamichi Ogasawara (2004). "(R)-3-phenyl-cyclohexanone". Org. Synth.; Coll. Vol. 10: 609.
- ^ Huang, Y; Walji, AM; Larsen, CH; Macmillan, DW. Enantioselective Organo-Cascade Catalysis. J. Am. Chem. Soc. (Free full text). 2005, 127 (43): 15051–15053. ISSN 0002-7863. PMID 16248643. doi:10.1021/ja055545d. 已忽略未知参数
|month=(建议使用|date=) (帮助);|author=和|last1=只需其一 (帮助) - ^ Marigo, M; Schulte, T; Franzén, J; Jørgensen, KA. Asymmetric Multicomponent Domino Reactions and Highly Enantioselective Conjugated Addition of Thiols to α,β-Unsaturated Aldehydes. J. Am. Chem. Soc. 2005, 127 (45): 15710–15711. ISSN 0002-7863. PMID 16277506. doi:10.1021/ja055291w. 已忽略未知参数
|month=(建议使用|date=) (帮助);|author=和|last1=只需其一 (帮助)
