醛:修订间差异
无编辑摘要 |
|||
| 第60行: | 第60行: | ||
=== 氧化方法 === |
=== 氧化方法 === |
||
醛的另外一个重要合成方法是通过:[[醇氧化]]。工业中,甲醛的大量合成即通过氧化[[甲醇]]获得。而过程中氧气被选为氧化剂,因为氧气属“绿色”试剂且廉价易得。实验室中则使用了更为多样的[[氧化剂]],其中最普遍的属:[[铬]](VI)试剂。[[氧化反应]]可通过醇和酸性[[重铬酸钾]]溶液共热制备,而过量的[[重铬酸]]能氧化醛到[[羧酸]]形态。因此,形成醛之后就必须立即[[减压]]蒸馏出反应体系,或使用更温和的试剂,如:[[吡啶重 |
醛的另外一个重要合成方法是通过:[[醇氧化]]。工业中,甲醛的大量合成即通过氧化[[甲醇]]获得。而过程中氧气被选为氧化剂,因为氧气属“绿色”试剂且廉价易得。实验室中则使用了更为多样的[[氧化剂]],其中最普遍的属:[[铬]](VI)试剂。[[氧化反应]]可通过醇和酸性[[重铬酸钾]]溶液共热制备,而过量的[[重铬酸]]能氧化醛到[[羧酸]]形态。因此,形成醛之后就必须立即[[减压]]蒸馏出反应体系,或使用更温和的试剂,如:[[氯铬酸吡啶盐|氯鉻酸吡啶鹽]](PCC)或[[重鉻酸吡啶鹽]](PDC)制备醛,从而不用担心其过分氧化为酸。<ref>{{OrgSynth | author = R. W. Ratcliffe | title = Oxidation with the Chromium Trioxide-Pyridine Complex Prepared in situ: 1-Decanal | collvol = 6 | collvolpages = 373 | year = 1988 | prep = cv6p0373}}</ref> |
||
[[File:Oxidation with cr reagent.png|thumb|center|844 px|醇氧化为醛,在不受控制的氧化剂条件下继续氧化为酸]] |
[[File:Oxidation with cr reagent.png|thumb|center|844 px|醇氧化为醛,在不受控制的氧化剂条件下继续氧化为酸]] |
||
:[O] + CH<sub>3</sub>(CH<sub>2</sub>)<sub>9</sub>OH → CH<sub>3</sub>(CH<sub>2</sub>)<sub>8</sub>CHO + H<sub>2</sub>O |
:[O] + CH<sub>3</sub>(CH<sub>2</sub>)<sub>9</sub>OH → CH<sub>3</sub>(CH<sub>2</sub>)<sub>8</sub>CHO + H<sub>2</sub>O |
||
2014年9月6日 (六) 07:27的版本

醛(拼音:quán;英文:aldehyde)是一种含有甲酰基的一类有机化合物。这种官能团具有结构通式:R-CHO,其中的羰基中心连接了一个氢原子与一个R基团。[1] 不带有R的基团称为醛基或甲酰基。醛与酮化合物的区别在于羰基所处的位置是在碳链骨架的末端或是在两个碳原子之间。醛在有机化学中很常见,许多的香水都属醛类。
结构和化学键
醛的通式为R-CHO,-CHO代表醛基。醛基是由羰基(-CO-)和一个氢原子连接而成的。醛基属sp2-杂化体,其碳平面中心通过一个双键连接氧原子另外一个单键连接氢原子,此处碳-氢键不存在酸性。由于醛可发生互变异构形成烯醇式,因此醛羰基的α氢具有一定的酸性,其pKa约为17左右,比普通的烷烃化合物的C-H键pKa=30左右强的多,[2] 这是由于:
- 甲酰基中心的吸电子效应;
- 醛的共轭碱,即烯醇的负离子能离域负电荷;
而第一点可以得到一个相关结论:醛基是有极性的,氧原子是碳氧鍵中的負偶極,將碳原子的電子扯向氧原子。
醛基(除甲醛外),可发生酮式或烯醇式互变(互变异构)。酮-烯醇互变异构可通过酸或碱催化引发。通常烯醇形态比例较少,但反应活性更强。
分类
按照烃基的不同,醛可分为:脂肪醛和芳香醛。 芳香醛的羰基直接连在芳香环上。
命名
简单的醛常用普通命名法。芳香醛中芳基可作为取代基来命名。多元醛命名时,应选取含羰基尽可能多的碳链作主链,并标明羰基的位置和羰基的数目。不饱和醛的命名除羰基的编号应尽可能小以外,还要表示出不饱和键所在的位置。许多天然醛都有俗名,例如,肉桂醛(cinnamaldehyde),茴香醛(anisaldehyde),视黄醛(retinal) 等。
词源

醛 最初是由尤斯图斯·冯·李比希从拉丁文 alcohol dehydrogenatus (dehydrogenated alcohol) 建立的。 [3] 最初,醛通常是按照醇的名称来命名,如:乙醛是按照乙醇来命名的。
名词甲酰基起源于拉丁语和意大利语的词汇 formica即蚂蚁,该词可认为是最小的醛,所以化学中常用的甲醛或甲酸,还可称作为:蚁醛和蚁酸。
物理性质
醛的性质大不相同,其具体性质取决于醛的分子大小。小分子的醛类大多易溶于水,如:甲醛,乙醛。挥发性醛大多具有刺激性气味。醛的降解可通过自身氧化来完成。
工业中有两种醛非常重要:甲醛和乙醛。它们有复杂的化学特性,因为两者都具有形成低聚物或多聚物的倾向。它们还可发生水合,形成偕二醇。多聚物与低聚物和其母体醛分子存在着化学平衡。
醛易于通过光谱方法来进行鉴定,如:红外光谱,醛的νCO键吸收一般出现在1700cm-1左右,νCH键吸收一般出现在2700cm-1左右。而在1H NMR谱中,醛基氢的位置一般在δ9左右,该信号属醛基氢的特征信号。
定性分析
醛可通过斐林试液或多伦试液进行鉴定。斐林试液为硫酸铜(Cu2+)与酒石酸钾钠盐的碱性(NaOH)溶液,铜离子可被醛还原产生紅色的氧化亚铜沉淀:
离子方程式: R-CHO + 2Cu2+ + 5OH− → R-COO− + Cu2O↓ + 3H2O
多伦试液为硝酸银的氨水溶液。当与醛共热,其二氨合银络离子会被醛还原而形成银单质析出,附于试管壁呈银镜,此反应也因此称为银镜反应:
化学方程式: R-CHO + 2[Ag(NH3)2]OH → R-COONH4 +2Ag↓ + 3NH3 + H2O
离子方程式: R-CHO + 2Ag(NH3)2+ + 2OH− → R-COO− +NH4+ +2Ag↓ + 3NH3 + H2O
应用与发现

天然产物中的醛
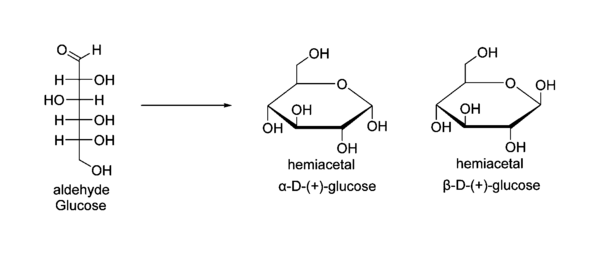
精油中发现了许多痕量的醛类,这都由于它们具有芳香气味,如:肉桂醛、芫荽醛和香草醛。可能由于甲酰基的高活泼性,醛基在天然产物(氨基酸、核酸、油脂)中较少见。大多数的糖类是醛的衍生物,这些“醛糖”普遍以半缩醛形式存在,少数一些以醛形式存在,如水溶液中的葡萄糖有很小的一部分以醛形式存在。
合成
许多反应都可进行醛的合成,[4] 但其中最主要的方法是:氢甲酰化反应。[5] 这里以丙烯酰化制备丁醛为例:
- H2 + CO + CH3CH=CH2 → CH3CH2CH2CHO
氧化方法
醛的另外一个重要合成方法是通过:醇氧化。工业中,甲醛的大量合成即通过氧化甲醇获得。而过程中氧气被选为氧化剂,因为氧气属“绿色”试剂且廉价易得。实验室中则使用了更为多样的氧化剂,其中最普遍的属:铬(VI)试剂。氧化反应可通过醇和酸性重铬酸钾溶液共热制备,而过量的重铬酸能氧化醛到羧酸形态。因此,形成醛之后就必须立即减压蒸馏出反应体系,或使用更温和的试剂,如:氯鉻酸吡啶鹽(PCC)或重鉻酸吡啶鹽(PDC)制备醛,从而不用担心其过分氧化为酸。[6]

- [O] + CH3(CH2)9OH → CH3(CH2)8CHO + H2O
此外氧化伯醇制备醛还可使用更为温和的条件,如:IBX、Dess-Martin过氧碘试剂、Swern氧化、TEMPO、或Oppenauer氧化。
在工业中还有一种常用的方法:Wacker法, 其操作让乙烯在铜和钯催化剂下氧化成乙醛。
特殊方法
| 反应方法 | 反应底物 | 备注 |
|---|---|---|
| 臭氧化 | 烯烃 | 非全取代烯烃通过臭氧化反应,而后还原后处理得到醛 |
| 有机还原 | 酯 | 通过二异丁基氢化铝(DIBAL-H)还原酯制备醛 |
| Rosenmund还原反应 | 酰氯 | 通过三叔丁氧基锂铝氢(LiAlH(O-t-C4H9)3)制备醛 |
| 维蒂希反应 | 酮 | 在改进的维蒂希反应中,使用甲氧基亚甲基三苯基膦试剂制备醛 |
| 甲酰化反应 | 亲核性芳烃 | 如:Vilsmeier-Haack反应 |
| 内夫反应 | 硝基化合物 | |
| Zincke反应 | 吡啶 | Zincke醛 |
| Stephen醛合成 | 腈 | 腈与氯化锡、盐酸制备醛 |
| Meyers合成 | 含氧氮杂环 | 恶嗪水解制备醛 |
| McFadyen-Stevens反应 | 酰肼 | 碱催化下,乙酰基磺酰基肼发生热力学分解制备醛 |
常见反应
醛具有很高的反应活性,参与了众多反应。[4] 从工业角度来看,重要的反应大多数是缩和反应,如:制备可塑剂和多羟基化合物、还原反应制备醇(尤其羰基醇类)。从生物角度,重要的反应主要包括:制备亚胺的反应,即甲酰基的亲核加成反应,如:氧化去胺反应、半缩醛结构(醛糖)。[4]
还原反应
甲酰基易被还原为伯醇(-CH2OH)。这种典型转化使用了催化氢化,或直接的转移氢化进行。
氧化反应
甲酰基还易被氧化成相应的羧酸(-COOH)。工业中最常用的氧化剂是空气或氧气。实验室条件下,常用的氧化试剂包括:高锰酸钾、硝酸、氧化铬和重铬酸。混合二氧化锰、氰化物、乙酸和甲醇可将醛转化成甲酯。[7]
还有一种氧化反应基于银镜反应,该反应中,醛与Tollens试剂混合(其制备方法为:滴加氢氧化钠溶液至硝酸银溶液中,得到析出的氧化银,而后滴加足量的氨水溶液以溶解析出的固体,并形成[Ag(NH3)2]+络合物)。此反应过程不会影响碳碳双键。取名“银镜反应”是由于形成的氧化银能够转化为银镜,从而鉴定醛基结构。
若醛不能够转化为烯醇式(没有α-H,如:苯甲醛),加入碱后可发生Cannizzaro反应。该反应机理即:歧化现象,反应最后产生自身氧化还原所形成的醇与酸。
亲核加成反应
亲核试剂易与羰基发生反应。在反应过程中,羰基碳发生sp3杂化而与亲核试剂键合,氧原子则被质子化:
- RCHO + Nu- → RCH(Nu)O-
- RCH(Nu)O- + H+ → RCH(Nu)OH
通常一个水分子在加成发生时会被脱除,这种反应称为:加成-消除或加成-缩和反应。以下是几个亲核加成反应的变化:
氧亲核试剂
在缩醛化反应中,在酸或碱催化下,醇分子进攻羰基,质子转移后形成半缩醛。酸性条件下, 半缩醛与另外一个醇继续反应得到缩醛和一分子水。除环状半缩醛,如:葡萄糖可以稳定存外,其他简单的半缩醛通常不稳定。而相比缩醛就稳定的多,只有酸性条件下会转化为相应的醛。醛还可与水反应形成水合物(R-C(H)(OH)(OH))。这些二醇分子在很强的吸电子基团存在下比较稳定,如:三氯乙醛,其稳定的机理被证实与半缩醛形态有关。
氮亲核试剂
在烷基氨化-去氧-双取代反应中,一级与二级胺进攻羰基,质子从氮原子转移至氧原子上,形成碳氮化合物。当底物为伯胺,一水分子可在该过程中消除,并形成亚胺,该反应通常由酸进行催化。此外羟氨(NH2OH)也可与醛基反应,所形成产物称为:肟;当亲核试剂是氨的衍生物(H2NNR2),如肼(H2NNH2)则形成了肼化合物,如:2,4-二硝基苯肼,其脱水后形成的化合物为:腙。该反应常用于鉴定醛酮。

碳亲核试剂
氢氰酸中的氰基可进攻羰基,形成氰醇(R-C(H)(OH)(CN))。在格氏反应中,格氏试剂进攻羰基,形成了格氏基团取代的醇。相类似的反应还有:Barbier反应和Nozaki-Hiyama-Kishi反应。在有机锡加成反应中,锡试剂取代了镁试剂参与该反应。
在羟醛缩和反应中,酮、酯、酰胺、羧酸的金属烯醇式也可进攻醛形成:β-羟基羰基化合物,即:羟醛。酸或碱催化的脱水反应能继续让上述化合物发生脱水反应,形成α,β-不饱和羰基化合物,以上两步反应即熟知的:羟醛缩和反应。当亲核基团替代为烯烃或炔烃进攻羰基,称为:Prins反应,该反应产物因不同反应条件与底物而改变。
更为复杂的反应
| 反应名称 | 产物 | 评论 |
|---|---|---|
| 沃尔夫-凯惜纳-黄鸣龙还原反应 | 烷烃 | 如果醛转化为简单的腙: (RCH=NHNH2) 并且和一个碱比如 KOH 加热,端基的碳原子能够还原为甲基。该反应是一种一锅法反应, 总反应为 RCH=O → RCH3. |
| 频哪醇偶联反应 | 二醇 | 在类似于镁的还原剂条件下进行 |
| 维蒂希反应 | 烯烃 | 在叶立德试剂条件下 |
| 高井反应 | 烯烃 | 在有机铬试剂条件下 |
| Corey-Fuchs反应 | 炔烃 | 磷-二溴甲基试剂条件下 |
| Ohira–Bestmann反应 | 炔烃 | 二甲基(偶氮甲基)磷酸酯试剂 |
| Johnson-Corey-Chaykovsky反应 | 环氧化物 | 硫叶立德试剂 |
| 氧-Diels-Alder反应 | 吡喃 | 醛在适合的催化剂条件下,可参与环加成反应。这种醛能够作为二烯的亲核物得到吡喃或者相应产物。 |
| 氢化酰化 | 酮 | 氢化酰化中,醛进攻不饱和化合物得到酮 |
| 脱羧反应 | 烷烃 | 由过渡金属催化 |
举例
相关化合物
其他拥有羰基的有机化合物:
参见
外部链接
- Aldehyde synthesis - Synthetic protocols from organic-reaction.com
参考文献
- ^ IUPAC Gold Book aldehydes
- ^ Chemistry of Enols and Enolates - Acidity of alpha-hydrogens
- ^ Crosland, Maurice P., Historical Studies in the Language of Chemistry, Courier Dover Publications, 2004
- ^ 4.0 4.1 4.2 Smith, Michael B.; March, Jerry, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure 6th, New York: Wiley-Interscience, 2007, ISBN 978-0-471-72091-1
- ^ W." Bertleff, M. Roeper, X. Sava, “Carbonylation” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2003. doi: 10.1002/14356007.a05_217.pub2
- ^ R. W. Ratcliffe (1988). "Oxidation with the Chromium Trioxide-Pyridine Complex Prepared in situ: 1-Decanal". Org. Synth.; Coll. Vol. 6: 373.
- ^ New methods for the oxidation of aldehydes to carboxylic acids and estersElias J. Corey, Norman W. Gilman, and B. E. GanemJ. Am. Chem. Soc.1968; 90(20) pp 5616 - 5617; doi:10.1021/ja01022a059.
