高锰酸盐:修订间差异
外观
删除的内容 添加的内容
补救1个来源,并将0个来源标记为失效。) #IABot (v2.0.7 |
无编辑摘要 标签:移除或更換文件 |
||
| 第4行: | 第4行: | ||
|1=zh-hans:高锰酸;zh-tw:過錳酸 |
|1=zh-hans:高锰酸;zh-tw:過錳酸 |
||
}} |
}} |
||
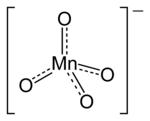
[[File:Permanganate-anion-2D.png|thumb|right|200px|高锰酸根离子的结构。]] |
|||
{{Chembox |
|||
| ImageFile1 = Permanganate-anion-2D.png |
|||
| ImageSize1 =150px |
|||
| ImageAlt1 = Lewis structure of the manganate(VII) anion |
|||
| ImageFile2 = Permanganate-anion-3D-balls.png |
|||
| ImageSize2 = 150px |
|||
| ImageAltL2 = [[Ball-and-stick model]] of the nitrate ion |
|||
| SystematicName = Permanganate |
|||
| IUPACName = |
|||
| OtherNames = |
|||
| Section1 = {{Chembox Identifiers |
|||
| CASNo = 14333-13-2 |
|||
| PubChem = 24401 |
|||
| ChemSpiderID = 22811 |
|||
| UNII = 2BL953CCZ2 |
|||
| DTXSID = DTXSID90912340 |
|||
| ChEBI = 25939 |
|||
| StdInChI=1S/Mn.4O/q;;;;-1 |
|||
| StdInChIKey = NPDODHDPVPPRDJ-UHFFFAOYSA-N |
|||
| SMILES = [O-][Mn](=O)(=O)=O |
|||
}} |
|||
| Section2 = {{Chembox Properties |
|||
| Formula = {{chem|MnO|4|−}} |
|||
| Mn=1|O=4 |
|||
| Appearance = |
|||
| Solubility = |
|||
| ConjugateAcid = [[高锰酸]]}} |
|||
| Section3 = {{Chembox Hazards |
|||
| MainHazards = |
|||
| FlashPt = |
|||
| AutoignitionPt = }} |
|||
}} |
|||
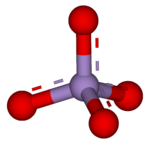
'''高锰酸盐'''是[[高锰酸]]所形成的盐,含有四面体型的'''高锰酸根'''离子—MnO<sub>4</sub><sup>−</sup>,其中[[锰]]的[[氧化态]]为+7,有强[[氧化性]]。[[高锰酸钾]]是最重要的高锰酸盐,为紫红色的针状晶体。 |
'''高锰酸盐'''是[[高锰酸]]所形成的盐,含有四面体型的'''高锰酸根'''离子—MnO<sub>4</sub><sup>−</sup>,其中[[锰]]的[[氧化态]]为+7,有强[[氧化性]]。[[高锰酸钾]]是最重要的高锰酸盐,为紫红色的针状晶体。 |
||
2020年10月19日 (一) 12:00的版本
此條目的引用需要清理,使其符合格式。 (2017年2月25日) |
| 高锰酸盐 | |
|---|---|
| |
| |
| 系统名 Permanganate | |
| 识别 | |
| CAS号 | 14333-13-2 |
| PubChem | 24401 |
| ChemSpider | 22811 |
| SMILES |
|
| ChEBI | 25939 |
| 性质 | |
| 化学式 | MnO4 |
| 摩尔质量 | 118.94 g·mol−1 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
高锰酸盐是高锰酸所形成的盐,含有四面体型的高锰酸根离子—MnO4−,其中锰的氧化态为+7,有强氧化性。高锰酸钾是最重要的高锰酸盐,为紫红色的针状晶体。
酸性溶液中,高锰酸根离子被还原为无色的Mn2+离子:
- 16 H3O+ + 2 MnO4− + 10 Cl− → 2 Mn2+ + 5 Cl2 + 24 H2O
- 6 H+ + 2 MnO4− + 5 HCOOH → 8 H2O + 2 Mn2+ + 5 CO2
碱性溶液中还原,既可得到棕色的MnO2(锰氧化态为+4),也可得到深绿色的MnO42−(锰氧化态为+6)。
- 4 OH− + 2 MnO4− + 3 C2O42− → 2 MnO2 + 6 CO32− + 2 H2O
- 3 OH− + 2 MnO4− + HSO3− → 2 MnO42− + SO42− + 2 H2O
生产
高锰酸盐可由锰化合物被强氧化剂氧化得到。可用的氧化剂如次氯酸钠、二氧化铅、高碘酸等:
- 2 MnCl2 + 5 NaClO + 6 NaOH → 2 NaMnO4 + 9 NaCl+ 3 H2O
- 2 MnSO4 + 5 PbO2+ 3 H2SO4 → 2 HMnO4+ 5 PbSO4 + 2 H2O
工业上制取高锰酸钾时,是用氯酸钾作氧化剂与二氧化锰共熔,使其转化为锰酸钾,然后用氯气氧化得到。
性质
高锰酸盐类似于高氯酸盐,性质较稳定,有很强的氧化性,常用在分析化学的氧化还原滴定中。它与还原性物质及有机物质混合可能发生燃烧或爆炸。加热到230°C时,高锰酸钾分解为锰酸钾、二氧化锰和氧气,这也是初中演示氧气制备的常用反应之一:
高锰酸根离子不能和二价锰离子共存,是因为:
- 2MnO4-(aq) + 3Mn2+(aq) + 2H2O ↔ 5MnO2(S) + 4H+[1]
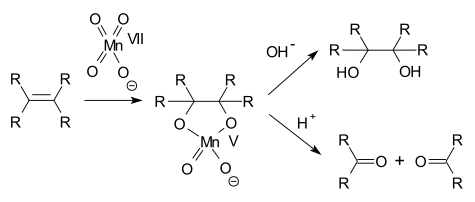
高锰酸盐(尤其是高锰酸钾)是有机合成中的氧化剂,它可以将胺氧化为相应的硝基化合物[2][3],将醇氧化为酮[4]或醛和羧酸[5][6],将其他烯烃氧化为邻二醇[7],以及将末端烯烃氧化为相应的羧酸[8]等。烯烃被高锰酸盐氧化的反应是通过一个环状的高锰酸酯机理进行的,碱性条件下的产物是二醇,酸性条件下则为两个酮,如下图所示。
化合物
参考资料
- ^ 高锰酸盐(法文):http://fr.wikipedia.org/wiki/Permanganate#Propri.C3.A9t.C3.A9s_oxydantes (页面存档备份,存于互联网档案馆)
- ^ OS 52:77 http://www.orgsynth.org/orgsyn/pdfs/CV6P0803.pdf
- ^ OS 43:87 http://www.orgsynth.org/orgsyn/pdfs/CV5P0845.pdf
- ^ OS 39:51 http://www.orgsynth.org/orgsyn/pdfs/CV4P0467.pdf
- ^ OS 10:82 http://www.orgsynth.org/orgsyn/pdfs/CV2P0538.pdf
- ^ OS 16:39 http://www.orgsynth.org/orgsyn/pdfs/CV2P0315.pdf
- ^ OS 11:52 http://www.orgsynth.org/orgsyn/pdfs/CV2P0307.pdf
- ^ OS 60:11 http://www.orgsynth.org/orgsyn/pdfs/CV7P0397.pdf
