置换反应:修订间差异
外观
删除的内容 添加的内容
无编辑摘要 |
无编辑摘要 |
||
| 第43行: | 第43行: | ||
==參考資料== |
==參考資料== |
||
==参见== |
==参见== |
||
* |
*化合反应 |
||
* |
*分解反應 |
||
* |
*复分解反应 |
||
[[category:化學反應|Z]] |
[[category:化學反應|Z]] |
||
2021年12月24日 (五) 22:54的版本
置換反應又稱單置換反應,是指一種元素或化合物的離子根與一種離子化合物發生的反應,狹義氧化還原反應是置換反應的一種,且必為廣義的氧化還原反應。在反應中,關鍵在於還原性或氧化性的強弱,還原性或氧化性強的物質與相對較弱的物質進行置換。置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应。
這就是反應的通式,其中:
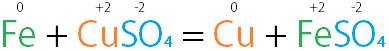
上面是一个置换反应的例子,反应前后各元素氧化態可能改变。
在置換反應中,只會有正離子或負離子的其中一方進行置換,沒有進行反應的離子為旁觀離子。上面的例子中硫酸根為旁觀離子。
反应式
在置換反應中,一般可以有兩種化學式,一種是標準的化學方程式,另一種是離子化學式(半化學式)。
基於旁觀離子並沒有進行化學反應,因此在化學方程式中省略旁觀離子的部份,並得出離子化學式。因此,離子化學式的左右兩方也帶有相同的電荷。
例子
假使A和B的離子電荷為2+,X為2-。
- 化學式:
- 實例:
- 離子化學式:
- 實例:
置換條件
發生反應的條件主要是看金屬的活性序,且一定發生在水中(狹義氧化還原反應不一定)。活性序排在前面的金屬可以與排在後面的金屬置換,因為排在愈前面的金屬愈容易失去電子。當水溶液中的離子化合物不止一種時,則會先和活性序較後面的金屬離子反應,如果活性序是排在能與水直接反應的金屬,則包括水分子中的氫離子在內。
狹義氧化還原與置換反應的比較
(加熱會使反應加速)
上面為狹義氧化還原反應的例子
參考資料
参见
- 化合反应
- 分解反應
- 复分解反应
- ^ Single Replacement Reactions. Chemistry LibreTexts. 2016-06-27 (英语).











