碳-氟鍵:修订间差异
Gesamtszenario(留言 | 贡献) 小 File:Carbon-fluorine-bond-polarity-2D-black.png → File:Carbon-fluorine-bond-polarity-2D-black.svg |
|
(没有差异)
| |
2023年4月5日 (三) 14:10的版本
此條目翻譯品質不佳,原文在en:Carbon–fluorine_bond。 |
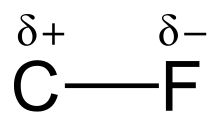
碳-氟鍵是在碳和氟的極性共價鍵,是所有有機氟化合物的組分。由於其局部的離子鍵特性,它是化學中最強的單鍵之一,強度僅次於硼-氟單鍵、矽-氟單鍵和氫-氟單鍵。往化合物中的同一碳原子上添加更多氟原子時,所構成的鍵會增強並縮短。因此,諸如四氟甲烷(四氟化碳)的氟代烷是一些最不活潑的有機化合物。
電負性和鍵的強度
氟的高電負性(氟:4.0,碳:2.5)給予碳-氟鍵顯著的極性/電偶極矩。電子云集中在氟原子一侧,使碳原子的電子云較為稀疏。由於這個特性,透過部分電荷 (Cδ+—Fδ−),碳-氟鍵具有離子鍵特性。氟和碳的部分電荷有吸引力,促成了碳-氟鍵不尋常的鍵結強度。這個鍵被稱為“有機化學中最強的”,因為氟與碳形成最強的單鍵。"[1]碳-氟鍵可以具有高達130 kcal/mol的鍵解離能(BDE)。[2]碳-氟鍵的BDE(鍵的強度)比其它碳-鹵素和碳-氫鍵的更高。例如,,某分子H3X中碳-X的BDE分別為115、104.9、83.7、72.1和57.6 kcal/mol(X = 氟、氫、氯、溴和碘)。[3]
鍵長
碳-氟鍵長通常為大約1.35埃(Å)(氟甲烷中則為1.39 Å)。[1]它比任何其他碳-鹵素鍵、碳-氮單鍵和碳-氧單鍵還短,儘管氟的原子質量較大。碳-氟鍵長,可以歸因於碳原子和氟原子的局部電荷之間的離子特性/靜電引力。 碳-氟鍵長可以有幾百分之一埃的變化,取決於碳原子的雜化和碳原子上的其它取代基,甚至涉及離原子更遠的地方。這些波動可以作為細微的雜化變化和立體電子效應的跡象。下表顯示平均鍵長在不同的鍵合環境(碳原子數是sp3雜化,除非另外說明是sp2或芳族碳)如何變化。
鍵結 平均鍵長(Å)[4] CCH2F, C2CHF 1.399 C3CF 1.428 C2CF2, H2CF2, CCHF2 1.349 CCF3 1.346 FCNO2 1.320 FCCF 1.371 Csp2F 1.340 CarF 1.363 FCarCarF 1.340
鍵長的改變和氟鍵的縮短是由於它們的部分離子特性,部分離子特性也可以在氟和其他元素之間觀察到,而困難的是該如何選擇適當的氟共價半徑的值。萊納斯•鮑林最初提出64pm,但該值最終被72pm取代,這是氟 - 氟鍵一半的長度。然而,72pm對於氟和其他元素之間的鍵而言,為過長的長度,所以其他作者提議以54pm至60pm之間的值作為氟共價半徑的值。[5] [6][7][8]
鍵結強度影響成對的鍵
隨著增加的氟原子,對相同的( 成對 )碳的其他鍵變得更強和更短。對氟甲烷系列而言,這可以看出鍵長和強度(BDE)的改變,如下面的表格所示;此外,在原子上的部分電荷(qC and qF)改變系列[2],當氟添加時,碳上的部分電荷變得更陽性,在氟和碳之間,增加靜電相互作用和離子特性。
化合物 碳 - 氟鍵長度(Å) BDE (kcal/mol) qC qF CH3F 1.385 109.9 ± 1 0.01 −0.23 CH2F2 1.357 119.5 0.40 −0.23 CHF3 1.332 127.5 0.56 −0.21 CF4 1.319 130.5 ± 3 0.72 −0.18
扭轉效應
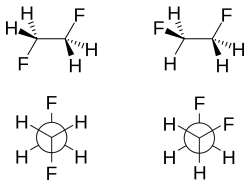
當2個氟原子是位在鄰位(即相鄰)的碳原子,如在1,2 - 二氟乙烷(H2FCCFH2),時,扭轉構象比反構象更穩定,這是相反於大部分的1,2 - 二取代乙烷類通常會被預期到和觀察到;此種現象被稱為扭轉效應(gauche effect) [9]。 1,2 - 二氟乙烷,該扭轉構象比反構象更穩定,在氣相中,更穩定2.4至3.4千焦耳/摩爾。這種效果不是指會出現在氟鹵素,然而; 扭轉效應,也可以在1,2 - 二甲氧基乙烷觀察到。一個相關的效果是烯烴順式作用。例如,1,2 - 二氟乙烯的順式異構體比反式異構體更穩定。[10]

這裡有兩個主要影響扭轉效應的解釋:超共軛和彎曲的鍵結。在超共軛的模型,從碳-氫σ鍵軌道到碳 - 氟σ*反鍵軌道的電子密度的捐贈被認為是穩定扭轉異構體的來源。由於氟更大的電負性,碳 - 氫σ軌道比碳氟σ軌道是更好的電子供體,而碳-氟σ*軌道比碳 - 氫σ*軌道為一個更好的電子受體。只有扭轉構象允許在更好的供體和受體之間的良好重疊。
在二氟乙烷扭轉效應的彎曲鍵關鍵解釋是,在兩個碳 - 氟鍵增加p軌域,由於氟的電負性大。其結果是電子密度建立在中央碳 - 碳鍵的上方、下方、左側和右側。由此此結果可以減少軌道重疊,當一個扭轉效應被假設,形成一個彎曲的鍵。在這兩種模式,超共軛通常被認為是二氟乙烷的扭轉效應的主要原因。[1][11]
光譜分析
在紅外光譜中,碳 - 氟鍵的伸縮出現在1000和1360 cm−1之間。寬範圍是由於偵查到其它在分子中的取代基。單氟化化合物在1000和1110 cm−1之間有著強大頻帶;超過一個以上的氟原子,頻帶分割成兩個頻帶,一個用於對稱模式,另一個用於不對稱[12],碳 - 氟頻帶是很強烈,導致它們可能掩蓋其他能存在的碳 - 氫頻帶[13]。
有機氟化合物也可以透過使用NMR光譜分析,用碳-13,氟-19(唯一的天然氟同位素) 或氫-1 (如果存在) 。在19F NMR的化學位移出現在很寬的範圍內,根據替代和官能團的程度。下表顯示範圍的一些主要類別。[14]
化合物類型 化學位移範圍 (ppm) (與CFCl3比較) F–C=O −70 to −20 CF3 +40 to +80 CF2 +80 to +140 CF +140 to +250 ArF +80 to +170
外部連結
參考文獻
- ^ 1.0 1.1 1.2 O'Hagan D. Understanding organofluorine chemistry. An introduction to the C–F bond. Chem Soc Rev. February 2008, 37 (2): 308–19. PMID 18197347. doi:10.1039/b711844a.
- ^ 2.0 2.1 Lemal DM. "Perspective on Fluorocarbon Chemistry" (页面存档备份,存于互联网档案馆) J Org Chem. 2004, volume 69, p 1–11. doi:10.1021/jo0302556
- ^ Blanksby SJ, Ellison GB. Bond dissociation energies of organic molecules. Acc. Chem. Res. April 2003, 36 (4): 255–63. PMID 12693923. doi:10.1021/ar020230d.
- ^ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
- ^ Gillespie, Ronald, and Edward Robinson. 1992 Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine. Inorganic Chemistry, 31, 1960-1963.
- ^ Robinson, Edward, Samuel Johnson, Ting-Hua Tang, and Ronald Gillespie. 1997. Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model. Inorganic Chemistry, 36, 3022-3030.
- ^ Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán and Santiago Alvarez. Covalent radii revisited. Dalton Trans., 2008, 2832-2838, doi:10.1039/b801115j
- ^ P. Pyykkö, M. Atsumi, Chem. Eur. J., 15, 2009,186-197 doi:10.1002/chem.200800987.
- ^ Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser J. Am. Chem. Soc.; 1997; 119(20) pp 4789 - 4790; (Communication) doi:10.1021/ja963819e
- ^ The stereochemical consequences of electron delocalization in extended .pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena Richard C. Bingham J. Am. Chem. Soc.; 1976; 98(2); 535-540 Abstract (页面存档备份,存于互联网档案馆)
- ^ Goodman, L.; Gu, H.; Pophristic, V.. Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion. J. Phys. Chem. A. 2005, 109, 1223-1229. doi:10.1021/jp046290d
- ^ George Socrates, Socrates. Infrared and Raman characteristic group frequencies: tables and charts. John Wiley and Sons. 2001: 198. ISBN 0-470-09307-2.
- ^ Barbara H. Stuart. Infrared Spectroscopy: Fundamentals and Applications. John Wiley and Sons. 2004: 82. ISBN 0-470-85428-6.
- ^ 存档副本. [2008-11-09]. (原始内容存档于2008-05-15).
