钠钾泵
钠钾泵(也可称为钠钾-ATPase, Na+/K+-ATPase),是一种位于细胞膜上的酶(EC 3.6.3.9)(或说得更精确一点,离子匣式跨膜ATP酶)可在人类细胞及后生动物中发现。
钠钾泵
钠钾泵可以将细胞内相对高浓度的钾离子送进细胞,并将相对低浓度的钠离子送出细胞。经由以具放射性的钠、钾离子标定,可以发现钠、钾离子都会经过这个通道,钠、钾离子的浓度在细胞膜两侧也都是相互依赖的,所以显示了钠、钾离子都可以经过这个载体运输。目前已知钠钾泵需消耗ATP,并可以将三个钠离子送出细胞,同时将两个钾离子送进细胞。
钠钾泵在1950年被丹麦的科学家延斯·斯科(Jens Skou)发现,它代表了我们对离子进出细胞的认识的一个重要的里程碑。它也在细胞刺激上有着重要的意义,像神经细胞的冲动,就是用钠钾泵帮助维持细胞电位使神经冲动得以传输。
功能
钠钾泵可以帮忙维持细胞保持在静止电位,帮助传输和调整细胞体积。他也有信号感应和整合的功能,和细胞内的钙离子一样帮助调整MAPK途径、ROS。
静止膜电位
为了维持细胞的电位,细胞内必须保持低浓度的钠离子和高浓度的钾离子。当细胞再极化时,细胞会打开钾离子通道而使细胞的内的钾离子经由钾离子通道离开细胞,使细胞内的电位越来越低到达静止电位。但当钾离子通道太晚关闭时,细胞内的电位就会过低,而形成了过极化的现象。为了回复适当的电位,钠钾泵经由水解ATP获得能量以主动运输将三个钠离子送出细胞,同时将两个钾离子送进细胞。最后细胞回复到静止电位而可以准备开始下一个动作电位。但有一点不要弄错,动作电位的产生跟钠钾泵并没有直接的关系。
控制细胞体积
钠钾泵的重要功能之一就是维持细胞体积,机制如下所述。在细胞内部有大量无法分泌至细胞外的物质,如蛋白质及胞器等,这些物质造成渗透压的差距,而使水由细胞外流入细胞内,若无调控则会导致细胞膨胀,甚至破裂。钠钾泵可避免此情况。泵将3个钠离子运出细胞,并运入2个钾离子。由于钠离子对膜的穿透性比钾离子差(钠的水合半径比钾大),因此让钠离子倾向留于细胞外,而造成细胞不断地流失离子,如此一来,产生相反的渗透压梯度,使水分子渗出细胞外。所以,一但细胞有开始膨胀的现象,就会自动活化钠钾泵将离子运出细胞外。
讯息转换子
在过去这些年中,许多实验室证明了这些膜蛋白除了可以做传统的离子运输外,亦可借由调控蛋白质上酪胺酸的磷酸化来结合细胞间的哇吧因(ouabain)传递讯息进入细胞内。借由哇吧因来触发蛋白质磷酸化产生的下游讯息包括有丝分裂活化蛋白质激酶(mitogen-activated protein kinase, MAPK)讯息的梯瀑效应(cascade)的活化、线粒体活性氧(reactive oxygen species, ROS)的产生、C型磷脂酶(phospholipase C, PLC)及肌醇三磷酸受体(inositol triphosphate receptor, IP3R)的活化。[1]
蛋白质交互作用对钠钾泵媒介的讯息传递是很重要的,如:钠钾泵与无接收子酪胺酸磷酸酶(Src,一种没有受体得酪胺酸激酶)结合形成接收子复合物(receptor complex)。[2]钠钾泵亦会与锚蛋白(ankyrin)、肌醇三磷酸受体(IP3R)、肌醇三磷酸激酶(PI3K)、C型磷脂酶γ(PLC-γ)及切丝蛋白(cofilin)结合。[3]
机制
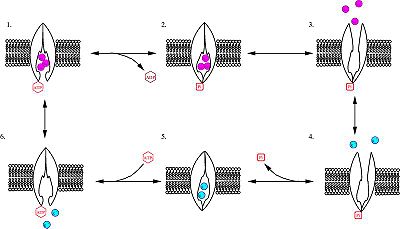
- ·泵接上ATP,并接上3的细胞内的钠离子。
- ·借由将ATP水解成ADP,使泵上高度保守的天冬胺酸片段(highly conserved aspartate residue)被磷酸化(phosphorylation)。
- ·磷酸化的泵构形改变(conformational change),对钠离子的亲和力(affinity)降低,而将钠离子释放至细胞外。
- ·泵接上2个细胞外的钾离子。此举造成泵去磷酸化(dephosphorylation),回复至原先构形,运送钾离子进入细胞内。
- ·无磷酸化的泵构形对钠离子的亲和力高于钾离子,因此2个钾离子离开泵,ATP接上,过程变重新开始。
调节
内生(Endogenous)
钠钾泵被认为可由cAMP来调降。[4]若物质造成cAMP浓度上升,则钠钾泵浓度下降;反之,若cAMP浓度下降,则纳钾泵浓度上升。
外生(Exopenous)
钠钾泵可被药物做修饰。例如,心脏细胞膜上的钠钾泵是强心甙类(cardiac glycosides)药物(如地高辛(digoxin)及ouabain)的重要作用目标,借由增强收缩力来促进心脏表现。
发现
丹麦科学家延斯·克里斯蒂安·斯科(Jens Christian Skou)在1957年发现钠钾泵[5],并在1997年获得诺贝尔化学奖。"for the first discovery of an ion-transporting enzyme, Na+, K+ -ATPase." [6]
基因
Alpha:ATP1A1[1], ATP1A2[2], ATP1A3[3], ATP1A4[4]
Beta:ATP1B1[5], ATP1B2, ATP1B3[6], ATP1B4
参考资料
- ^ Na/K-ATPase Tethers Phospholipase C and IP3 Receptor into a Calcium-regulatory Complex by Zhaokan Yuan, Ting Cai, Jiang Tian, Alexander V. Ivanov, David R. Giovannucci, and Zijian Xie in Molecular Biology of the Cell (2005) volume 16, pages 4034-4045.
- ^ Binding of Src to Na+/K+-ATPase Forms a Functional Signaling Complex by Jiang Tian, Ting Cai, Zhaokan Yuan, Haojie Wang, Lijun Liu, Michael Haas, Elena Maksimova,‡ Xin-Yun Huang and Zi-Jian Xie in Molecular Biology of the Cell (2005) volume 17, pages 317-326.
- ^ Interaction of the alpha subunit of Na,K-ATPase with cofilin by K. Lee, J. Jung, M. Kim and G. Guidotti in The Biochemical Journal (2001) volume 353, pages 377–385.
- ^ Regulation of Na+-K+-ATPase by cAMP-dependent protein kinase anchored on membrane via its anchoring protein Kinji Kurihara, Nobuo Nakanishi, and Takao Ueha. Departments of 1 Oral Physiology and 2 Biochemistry, School of Dentistry, Meikai University, Sakado, Saitama 350-0283, Japan
- ^ Skou J. The influence of some cations on an adenosine triphosphatase from peripheral nerves.. Biochim Biophys Acta. 1957, 23 (2): 394–401. PMID 13412736. doi:10.1016/0006-3002(57)90343-8.
- ^ Chemistry 1997
