氯化金
| 三氯化金 | |
|---|---|

| |
| |
| IUPAC名 Gold(III) chloride 氯化金 (III) | |
| 英文名 | Gold (III) chloride |
| 别名 | 氯化金 三氯化金 |
| 识别 | |
| CAS号 | 13453-07-1 |
| PubChem | 26030 |
| SMILES |
|
| InChI |
|
| 性质 | |
| 化学式 | AuCl3 (实际上为双聚体Au2Cl6) |
| 摩尔质量 | 303.325 (无水) g·mol⁻¹ |
| 外观 | 红色晶体 |
| 密度 | 3.9 g/cm3(固体) |
| 熔点 | 254℃(527 K)(分解) |
| 溶解性(水) | 68 g/100 ml(冷) |
| 溶解性(乙醇、乙醚) | 可溶 |
| 结构 | |
| 晶体结构 | 单斜晶系 |
| 危险性 | |
| 主要危害 | 刺激性 |
| NFPA 704 | |
| 相关物质 | |
| 其他阴离子 | 三氟化金 三溴化金 |
| 其他阳离子 | 一氯化金 氯化银 二氯化铂 氯化汞 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
三氯化金,俗称氯化金,是最常见的无机金化合物,化学式是AuCl3。名称中的罗马数字表明金的化合价为+3,这是它众多化合物中最为稳定的价态。金亦会形成另一种氯化物——氯化亚金(AuCl),它没有AuCl3稳定。另外,把金溶于王水便会产生氯金酸,有时也会非正式地称为:“氯化金”、“三氯合金酸”或是“三水合氯化金(III)”[来源请求]。
氯化金(III)吸湿性很强,极易溶于水及乙醇。温度高于160 °C或光照时会分解,并产生多种有大量配体的配合物。
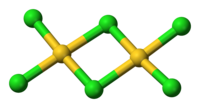
结构
固态和气态的三氯化金都是二聚物;金的溴化物——AuBr3也是如此。两个Au分别位于两个正方平面的中心。此结构称为平面型结构[1] ,AlCl3及FeCl3也属于这个结构。AuCl3中的化学键主要是共价的,反映了它的高化合价和相对高的电负性。
化学性质
无水AuCl3在160℃左右分解为AuCl。但后者更高温时会发生歧化反应,生成金属金及AuCl3。
- AuCl3 → AuCl + Cl2 (>160℃)
- 3AuCl → AuCl3 + 2Au (>420℃)
AuCl3是一种路易斯酸,可生成多种加合物,例如:与盐酸反应生成氯金酸(HAuCl4):
- HCl(aq) + AuCl3(aq) → H+ + AuCl4(aq)−
三氯化金的水溶液极易与其它金属反应置换出金属金,原因是金的活性序排在很后面,因此只要排在它前面都能与它置换,例如镁、铝、铜反应式为:
2AuCl3+3Mg→3MgCl2+2Au
AuCl3+Al→AlCl3+Au
2AuCl3+3Cu→3CuCl2+2Au
一些氯化物,例如氯化钾也会与AuCl3反应,生成AuCl4−。
AuCl3溶液与碱(例如氢氧化钠)反应,生成不纯的Au(OH)3沉淀,此沉淀溶于过量的氢氧化钠中生成金酸钠NaAuO2。Au(OH)3受热时,会分解成氧化金(Au2O3),再进一步分解成金属金。[2][3][4][5][6][7]
制备
最常用的制备氯化金(III)的方法,是直接在高温中氯化该金属:
- 2Au + 3Cl2 → 2AuCl3
- Au+HNO3+3HCl→AuCl3+NO↑+2H2O
- AuCl3+HCl↔HAuCl4
第二个反应式是可逆反应,因此当加入活性序排在金前面的金属就会使整体反应向左。
用途
三氯化金是最常见的金化合物之一,因此常用作合成许多其他金化合物的起始点。例如:溶于水的氰化物配合物——KAu(CN)4:
- AuCl3 + 4KCN → KAu(CN)4 + 3KCl
金(III)盐,特别是NaAuCl4(由AuCl3与NaCl反应制得),可取代有毒的汞(II)盐作为炔烃反应的催化剂。例如,通过终端炔烃的水合作用来制备甲基酮:[8]
一般在这些条件下,酮的产量可达90%。还有一个用途是在炔烃的胺化反应中作为催化剂。
近年,AuCl3开始引起有机化学家的青睐,因为它可作为其他化学反应的弱酸性催化剂,例如:芳香烃的烷基化反应,以及把呋喃转换成苯酚(见下)。在有机物的合成以及在制药工业中也会用到此化学反应。例如:2-甲基呋喃(斯而烷)可在第5位置与甲基乙烯基酮顺利发生烷基化反应:
File:AuCl3 furan alkylation.gif
常温下,用甲基腈中1 mole%的AuCl3只需进行40分钟的反应便可产生91%的产物。这个产量值得注意,因为呋喃和酮通常在酸性环境下极易发生聚合反应等的副反应。有时当炔烃存在时,会生成苯酚:[9]
此反应中,碳原子经历了一系列复杂的重排,产生新的芳香环。[10]
注意事项
参考资料
- ^ Egon Wiberg; Nils Wiberg; A. F. Holleman. Inorganic Chemistry 101. Academic Press. 2001: 1286–1287. ISBN 0123526515.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990
- ^ The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960
- ^ H. Nechamkin, The Chemistry of the Elements), McGraw-Hill, New York, 1968
- ^ A. F. Wells, Structural Inorganic Chemistry , 5th ed., Oxford University Press, Oxford, UK, 1984
- ^ G. Dyker, An Eldorado for Homogeneous Catalysis? , in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48-55, Wiley-VCH, Weinheim, 2003
- ^ Y. Fukuda, K. Utimoto, J. Org. Chem. 56, 3729-3731 (1991)
- ^ A. S. K. Hashmi, T. M. Frost, J. W. Bats, J. Am. Chem. Soc. 122, 11553-11554 (2000)
- ^ Hashmi, A. S. K.; Rudolph, M.; Weyrauch, J. P.; Wölfle, M.; Frey, W.; Bats, J. W. Angew. Chem. Int. Ed. 2005, 44, 2798-2801




