胺
此條目需要擴充。 (2009年8月14日) |
胺類(英語:amine)是氨分子(NH3)中的氫被烴基取代後形成的一類有機化合物,簡稱「胺」。胺基(-NH2、-NHR、-NR2)是胺的官能基。如果氮原子連著羰基(C=O),那麼該化合物則稱為醯胺,其化學性質與胺並不相同。
地區詞
在中國大陸,「胺」字僅用於詞根(詞尾綴),即當胺基是化合物主要官能基時在詞尾出現,例如「亞硝胺」(主要官能基為胺基)、「氨基酸」(主要官能基為羧基)等,「胺」、「氨」與「胺」類似「氫氧」、「水/羥」與「醇/酚」的對立。
在台灣,「胺」字更為廣義地包含任何胺基官能基,而「氨」字則僅包含氨氣和氨水,「胺」、「氨」與「胺」類似「氫氧」、「水」與「羥/醇/酚」的對立。
注意:不應將「胺」(-amine)寫成「氨」(ammonia),兩者意義與英文名稱皆不相同。
胺的分類
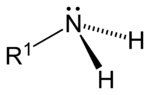
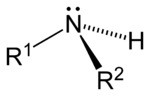
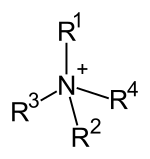
此外,胺還可根據氨分子上被取代的氫原子數量,順次分為一級胺(伯胺)、二級胺(仲胺)、三級胺(叔胺)。此外,還有四級銨鹽(季銨鹽),可以看成是銨根離子(NH4+)的四個氫都被取代的產物。
| 一級胺 | 二級胺 | 三級胺 | 四級銨鹽 |
|---|---|---|---|
| 伯胺 | 仲胺 | 叔胺 | 季銨鹽 |
 |
 |
 |
|
命名法
胺有幾個命名法。一般地,胺類化合物有「胺基」前綴或「胺」後綴。前綴「N-」表示氮原子被取代。有多個胺基的有機化合物稱為二胺、三胺、四胺等。
一些常見胺類的系統名稱:
| 低級胺類有「胺」後綴。 |
高級胺類的胺是官能團,使用「胺基」。IUPAC不建議採用這個慣例,[來源請求]反而建議使用如戊-2-胺的格式。 |
物理性質
一級胺及二級胺的物理性質主要受氫鍵影響,然而因為氮與氫陰電性的差別(3.0 − 2.1 = 0.9)並無氫和氧間(3.5 − 2.1 = 1.4)那麼大,所以一般N-H...H氫鍵較不像O-H...H鍵那麼強,故胺的沸點一般較相對的磷烴為高,卻低於相對應的醇。 例如,
| 乙烷 | 甲胺 | 甲醇 | |
|---|---|---|---|
| 分子量 | 30 | 31 | 32 |
| 沸點 | -88 | -7 | 65 |
甲胺和乙胺在室溫之下為氣體,但甲醇和乙醇在室溫之下為液體。甲醇與甲胺分子量相近,其沸點差異卻甚大。 幾乎所有胺類皆與水形成氫鍵,所以比同分子量的烴易溶於水,低分子量的胺類與水完全互溶,高分子胺類只適量溶於水。 氣體胺帶有一種類似氨的氣味,液體胺則帶有一種容易辨出的魚腥味。
掌性

|
⇌ | 
|
| 胺的手性翻轉 | ||
氮原子連有三個不同基團形如NHRR′與NRR′R″的胺是有手性的,因氮有一對孤對電子,分子呈三角錐形,氮是手性中心。唯其手性翻轉能壘相對很低,對於三烷基胺通常只需活化能25-37.6 kJ/mol,兩個對映體在室溫下就能迅速轉化故對映體不能分離。[1]若四級銨鹽氮所連四個基團不同,則能拆分出旋光異構物。有些環狀的胺因位阻不能翻轉成對映體也能拆分。
合成
鹵化物氨解(Ammonolysis of halides)
氨或胺氮上有孤對電子,作為親核試劑與鹵烷發生親核取代反應,按SN2機理進行。許多有機鹵化物以氨水溶液或氨溶液處理則變成胺類:
- RX + NH3 → RNH3 + X-
- RNH3+X- + NH3 → RNH2 + NH4+ + X-
- (X為鹵素)
用醇製備
胺的主要合成方法是氨的烷基化。工業上使用醇與氨合成有機胺:
- ROH + NH3 → RNH2 + H2O
這些反應需要使用催化劑、特製儀器及額外純化,因為得到的是一、二、三級胺的混合物,需要提高反應的選擇性。
其它方法
其它胺合成方法見下表:
| 反應名稱 | 原料 | 注釋 |
|---|---|---|
| 蓋布瑞爾一級胺合成反應 | 鹵烷 | 試劑:鄰苯二甲醯亞胺。製備一級胺的高選擇性方法。 |
| 施陶丁格反應 | 疊氮化物 | 也可使用還原劑四氫鋁鋰。 |
| 施密特反應 | 羧酸 | |
| Aza-Baylis–Hillman反應 | 亞胺 | 烯丙基胺的合成 |
| 霍夫曼降解 | 醯胺 | 只適用於製備一級胺,並且不會有二三級胺副產物。 |
| 霍夫曼脫去反應 | 四級銨鹽 | 強鹼處理得四級銨鹼,再消除 |
| 醯胺還原 | 醯胺 | 醯胺被強還原劑如四氫鋁鋰還原 |
| 腈催化加氫 | 腈 | |
| 硝基化合物的還原 | 硝基化合物 | 還原劑可以是鋅,錫,鐵,在酸溶液中 |
| 杜勒平反應 | 鹵代烴 | 試劑六亞甲基四胺 |
| Buchwald–Hartwig偶聯反應 | 鹵代芳香烴 | 合成芳胺的重要方法。 |
| 門秀金反應 | 三級胺 | 生成四級銨鹽 |
| 胺加成 | 烯烴與炔烴 | |
| Hofmann–Löffler–Freytag反應 | N-鹵代胺 |
參考資料
- ^ 邢其毅等.《基礎有機化學》第三版 下冊.北京:高等教育出版社,2005年.ISBN 978-7-04-017755-8


