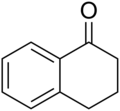
1-四氢萘酮
| 1-四氢萘酮 | |
|---|---|
| |
| |
| IUPAC名 3,4-Dihydro-2H-naphthalen-1-one 3,4-二氫-2H-1-萘酮 | |
| 别名 | α-四氫萘酮 1-萘滿酮 |
| 识别 | |
| CAS号 | 529-34-0 |
| PubChem | 10724 |
| ChemSpider | 10273 |
| SMILES |
|
| InChI |
|
| InChIKey | XHLHPRDBBAGVEG-UHFFFAOYAD |
| 性质 | |
| 化学式 | C10H10O |
| 摩尔质量 | 146.19 g·mol−1 |
| 外观 | 無色液體 |
| 密度 | 1.099 g·cm−3 (25 ℃)[1] |
| 熔点 | 2–7 °C[1] |
| 沸点 | 255–257 °C[2] 113–116 °C (8 hPa)[1] |
| 溶解性(水) | 不可溶[3] |
| 溶解性 | 可溶於有机溶剂 |
| 蒸氣壓 | 2.7 Pa (20 °C)[3] |
| 折光度n D |
1.5672 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
1-四氫萘酮是一種二環芳香烃和酮。就其結構而言,它也可以視作跟苯結合的環己酮。它是有淡淡氣味的無色油状液体,[4]用作農用和醫用藥品的起始物料。1-四氫萘酮的碳骨架出現於某些天然产物,例如用於中医学的马兜铃科植物的Aristelegone A(4,7-二甲基-6-甲氧基-1-四氫萘酮)中。[5]
製備
[编辑]通過四氫化萘的氧化
[编辑]1933年,海因里希·霍克(Heinrich Hock)講述過,四氢化萘往往會被空氣中的氧自然氧化,慢慢生成1-氢过氧化物。[6]在Cr3+[7]或Cu2+溶液的催化下,四氫化萘会在空氣下氧化,通過氫過氧化物中間體生成1-四氫萘醇和1-四氫萘酮的混合物。[8]
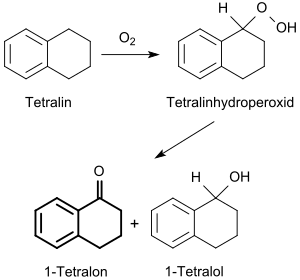
主要成分1-四氫萘酮(255-257 °C)和次要成分1-四氫萘醇(255 °C)的沸點[2]基本一樣,所以後者會通過化學反應去除。[9]
通過傅-克反應
[编辑]初始化合物4-苯基丁酸可以通過使用鈀接觸催化劑,將3-苯甲酰丙酸催化氫化取得。[4]3-苯甲酰丙酸则可以經過苯和琥珀酸酐的Haworth反應(傅-克反应反應的變化)取得。[10]
4-苯基丁酸环化成1-四氫萘酮的反应可以被多聚磷酸[4]和甲基磺酸催化。[11]
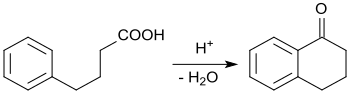
它被描述為一個化學課的教學實驗。[需要解释][12]4-苯基丁酸也可通過在强路易斯酸催化劑(如雙(三氟甲磺酰基)酰胺铋(Bi(NTf2)3))存在下加熱1-四氫萘酮而成。[13][14]
使用酰氯和氯化锡的反應時間比4-苯基丁酸的傅-克酰化反應的短得多。[9]

有推电子基的4-苯基丁酸氯化物可以通過強氫鍵形成劑六氟异丙醇(HFIP),在收率大於90%的緩和反應條件下環化至1-四氫萘酮。[15]
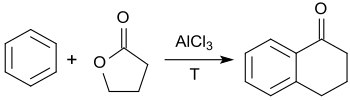
苯和γ-丁内酯在AlCl3催化下酰化,可以生成1-四氫萘酮。[9]
反應
[编辑]1-四氫萘酮在液氨中可被锂經伯奇还原反应還原成1,2,3,4-四氫化萘。[16]加入氯化銨水溶液並等氨蒸發後,酮基也可被還原成仲醇,生成1-四氫萘醇。[17]

1-四氫萘酮可以在-33 °C下被钙的液氨溶液还原成1-四氫萘醇,收率為81%。[18]
酮基α位的亞甲基特別活潑,可以在N-甲基苯胺的三氟乙酸鹽存在下和三聚甲醛反应生成2-亞甲基-1-四氫萘酮,收率高達91%。
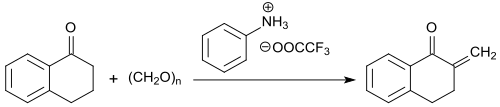
这种化合物在-5 °C以下穩定,但在室溫下会在12小時內完全聚合。[19]
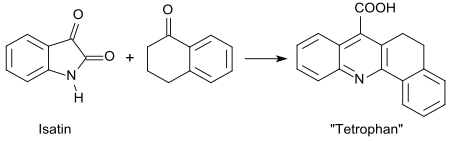
1-四氫萘酮和靛红經普菲青格反应會生成一種名為tetrofan(3,4-二氫-1,2-苯並吖啶-5-羧酸)的化合物。
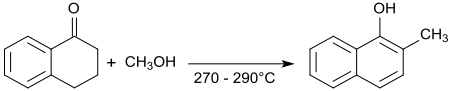
1-四氫萘酮和甲醇在270-290 °C的反應也利用α-亞甲基的反應性,通過脫氫和芳香萘環系的形成以66%的收率生成2-甲基-1-萘酚。[20]
1-四氫萘酮的肟會跟乙酸酐反應,將環酮環芳构化,生成N-(1-萘基)乙酰胺。[21]其生物性質類似於用作合成生长素的1-萘乙酸。
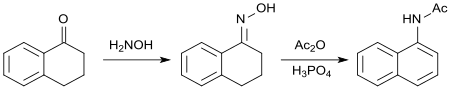
1-四氫萘酮和苯基溴化镁的格氏反应所生成的叔醇消除水後會跟乙酸酐反應,生成1-苯基-3,4-二氫化萘,使用硫磺脫水後生成1-苯基萘,總收率大約為45%。[22]
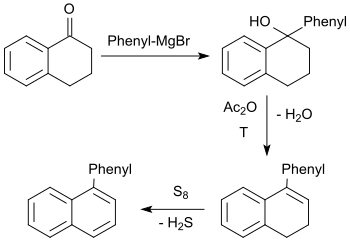
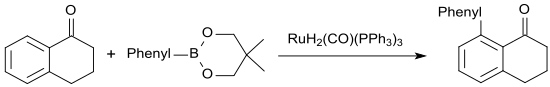
在釕(II)催化下,1-四氫萘酮可被苯硼酸新戊二醇酯芳基化,生成8-苯基-1-四氫萘酮,收率高達86%。[23]
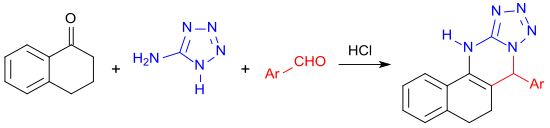
通過5-氨基四唑和一個芳香醛,1-四氫萘酮在微波輻射下經過多组分反应,生成四环杂环系统。[24]
應用
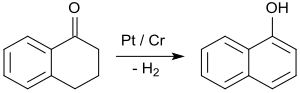
[编辑]1-四氫萘酮最重要的應用是合成1-萘酚,[25]而1-萘酚是杀虫剂甲萘威和Β受体阻滞剂普萘洛尔[26]的前体。
安全
[编辑]在一次對兔子的毒理學研究中,1-四氫萘酮的半數致死量經計算為2192 mg·kg−1。[1]
參考文獻
[编辑]- ^ 1.0 1.1 1.2 1.3 来源:Sigma-Aldrich Co., α-Tetralon (25. November 2017查阅).
- ^ 2.0 2.1 William M. Haynes, CRC Handbook of Chemistry and Physics, 97th Edition, Boca Raton, FL, U.S.A.: CRC Press: 3–504, 2016, ISBN 978-1-4987-5429-3
- ^ 3.0 3.1 alpha-Tetralone 529-34-0 | TCI Deutschland GmbH. www.tcichemicals.com. [2017-12-17]. (原始内容存档于2018-10-07) (德语).
- ^ 4.0 4.1 4.2 H.R. Snyder, F.X. Werber. α-Tetralone. Org. Synth. 1940, 20: 94. doi:10.15227/orgsyn.020.0094.
- ^ P.-C. Kuo; Y.-C. Li; T.-S. Wu, Chemical constituents and pharmacology of the Aristolochia species, EJTCM 2 (4), 2012, 2 (4): 249–266, PMC 3942903
 , PMID 24716140, doi:10.1016/S2225-4110(16)30111-0
, PMID 24716140, doi:10.1016/S2225-4110(16)30111-0 
- ^ H. Hock; W. Susemihl, Autoxydation von Kohlenwasserstoffen: Über ein durch Autoxydation erhaltenes Tetrahydro-naphthalin-peroxyd (I. Mitteil.), 德国化学学报 66 (1), 1933, 66 (1): 61–68, doi:10.1002/cber.19330660113 (德语)
- ^ S. Bhattacharjee; Y.-R. Lee; W.-S. Ahn, Oxidation of tetraline to 1-tetralone over CrAPO-5, Korean J. Chem. Eng. 34 (3), 2017, 34 (3): 701–705, doi:10.1007/s11814-016-0310-4 (德语)
- ^ US 4473711,R.W. Coon,「Liquid-phase process for oxidation of tetralin」,发表于1984-09-25
- ^ 9.0 9.1 9.2 C.E. Olson, A.R. Bader. α-Tetralone. Org. Synth. 1955, 35: 95. doi:10.15227/orgsyn.035.0095.
- ^ L. F. Somerville, C. F. H. Allen. β-Benzoylpropionic acid. Org. Synth. 1933, 13: 12. doi:10.15227/orgsyn.013.0012.
- ^ V. Premasagar; V.A. Palaniswamy; E.J. Eisenbraun, Methanesulfonic acid catalyzed cyclization of 3-arylpropanoic and 4-arylbutanoic acids to 1-indanones and 1-tetralones, 有机化学期刊 46 (14), 1981, 46 (14): 2974–2976, doi:10.1021/jo00325a028
- ^ M.S. Holden; R.D. Crouch; K.A. Barker, Formation of α-tetralone by intramolecular Friedel-Crafts acylation, J. Chem. Educ. 82 (6), 2005, 82 (6): 934–935, doi:10.1021/ed082p934
- ^ S. Antoniotti; E. Dunach, Facile preparation of metallic triflates and triflimidates by oxidative dissolution of metal powders, Chem. Commun. 8 (8), 2008, 8 (8): 993–995, doi:10.1039/B717689A
- ^ D.-M. Cui; M. Kawamura; S. Shimada; T. Hayashi; M. Tanaka, Synthesis of 1-tetralones by intramolecular Friedel-Crafts reaction of 4-arylbutyric acids using Lewis acid catalysts, 四面体通讯 44 (21), 2003, 44 (21): 4007–4010, doi:10.1016/S0040-4039(03)00855-4
- ^ H. Motiwala; R.H. Vekariya; J. Aubé, Intramolecular Friedel-Crafts acylation reaction promoted by 1,1,1,3,3,3-hexafluoro-2-propanol, 有机化学通讯 17 (21), 2015, 17 (21): 5484–5487, PMID 26496158, doi:10.1021/acs.orglett.5b02851 (德语)
- ^ S.S. Hall; S.D. Lipsky; F.J. McEnroe; A.P. Bartels, Lithium-ammonia Reduction of Aromatic Ketones to Aromatic Hydrocarbons, 有机化学期刊 38 (18), 1971, 38 (18): 2588–2591, doi:10.1021/jo00817a004
- ^ Z. Marcinow; P.W. Rabideau, Metal-Ammonia Reduction of α-Tetralone. Competition Between Ring Reduction, Carbonyl Reduction, and Dimer Formation, 有机化学期刊 53 (9), 1988, 53 (9): 2117–2119, doi:10.1021/jo00244a054
- ^ J.R. Hwu; Y.S. Wein; Y.-J. Leu, Calcium metal in liquid ammonia for selective reduction of organic compounds, 有机化学期刊 61 (4), 1996, 61 (4): 1493–1499, doi:10.1021/jo951219c (德语)
- ^ Methylene ketones and aldehydes by simple, direct methylene transfer: 2-Methylene-1-oxo-1,2,3,4-tetrahydronaphthalene. Organic Syntheses. 1981, 60: 88. doi:10.15227/orgsyn.060.0088.
- ^ I. Yuranov; L. Kiwi-Minsker; A. Renken, One-step vapour-phase synthesis of 2-methyl-1-naphthol from 1-tetralone, Appl. Catal. A 226 (1–2), 2002, 226 (1–2): 193–198 [2021-11-08], doi:10.1016/S0926-860X(01)00902-4, (原始内容存档于2021-11-08) (德语)
- ^ M.S. Newman; W.M. Hung, An improved aromatization of α-tetralone oximes to N-(1-naphthyl)acetamides, 有机化学期刊 38 (23), 1973, 38 (23): 4073–4074, doi:10.1021/jo00987a029 (德语)
- ^ 1-Phenylnaphthalene. Organic Syntheses. 1944, 24: 84. doi:10.15227/orgsyn.024.0084.
- ^ "Ruthenium-catalyzed arylation of ortho C-H bond in an aromatic with an arylboronate: 8-Phenyl-1-tetralone". Org. Synth..
- ^ G.P. Kantin; M. Krasavin, Reaction of α-tetralone, 1H-tetrazol-5-amine, and aromatic aldehydes upon microwave irradiation – a convenient method for the synthesis of 5,6,7,12-tetrahydrobenzo[h]tetrazolo[5,1-b]quinazolines, Chem. Heterocycl. Compd. 52 (11), 2016, 52 (11): 918–922, doi:10.1007/s10593-017-1985-0 (德语)
- ^ DE 2421745,K. Kudo, T. Ohmae, A. Uno,「Verfahren zur Herstellung von α-Naphthol durch katalytische Dehydrierung von α-Tetralon」,发表于1975-11-20
- ^ Kaiser, Carl; Jen, Timothy; Garvey, Eleanor; Bowen, Wayne D.; Colella, Donald F.; Wardell, Joe R. Adrenergic agents. 4. Substituted phenoxypropanolamine derivatives as potential .beta.-adrenergic agonists. Journal of Medicinal Chemistry (American Chemical Society (ACS)). 1977, 20 (5): 687–692. ISSN 0022-2623. doi:10.1021/jm00215a014.
