P4-t-Bu
| P4-t-Bu | |
|---|---|

| |
| 识别 | |
| CAS号 | 111324-04-0 |
| PubChem | 4339838 |
| SMILES |
|
| 性质 | |
| 化学式 | C22H63N13P4 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
P4-t-Bu是一种中性、全烷基化的空间位阻的聚氨基磷腈,是极强的碱,但亲核性非常弱。 P4-t-Bu可以看成基本结构为(H2N)3P=NH的三氨基亚氨基正膦的四聚体。表示P1至P7聚氨基[1][2]的同系物的通式,倾向于选择甲基为R1,甲基或叔丁基为0和6之间的偶数x (P4-t-Bu: R1 = Me, R2 = t-Bu und x = 3 )[3]由 Reinhard Schwesinger 开发。因此,所得的磷腈碱也称为Schwesinger超碱。[4][5]
制备
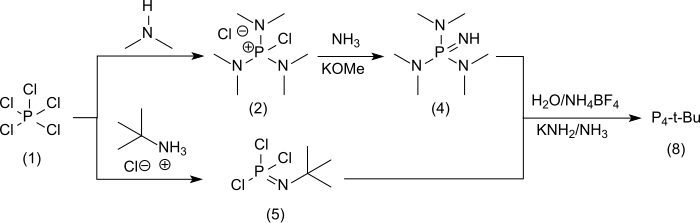
[编辑]P4-t-Bu[6]的合成通过五氯化磷(1),并在 [A] 中通过非分离的氯 (二甲氨基) 氯化𬭸(2)[2]经由 [(二甲氨基) 𬭸四氟硼酸盐 (3) 并进一步经由 [A2] 得到液态亚氨基三(二甲氨基)正膦[7] (4)
| [] |
并在支路 [ B ] 中与五氯化磷和叔丁基氯化铵合成叔丁基磷酰亚胺三氯化物 (5)[8]
| [] |
过量(4)与(5)反应[ C ]得到目标产物P4-t-Bu(6)的盐酸盐,收率93%
| [] |
它也可以转化为四氟硼酸盐 (7),可以用甲醇钾/氨基钠[2]或用氨基钾在液氨中几乎定量地从中获得游离碱 (8)。[9]将吸湿性和易溶于水的盐酸盐和液体游离碱转移到难溶于水的四氟硼酸盐中,极大地促进了物质的处理。
 | [] |
相对简单的合成、易于获得的反应物和非常好的中间体产率使 P4-t-Bu成为一种有吸引力的的磷腈超碱。[10]
特性
[编辑]P4-t-Bu是最强的中性含氮碱的外推pKa值为42.1,与pKa值为24.3的强碱DBU相比,碱性强18个数量级。[2]该化合物极易溶于非极性溶剂,如己烷、甲苯或四氢呋喃,通常以0.8至1摩尔的己烷溶液形式市售。[10]在弱酸性介质中质子化产生了极度离域和柔软的P4-t-Bu-H阳离子,并且除了非常强的增溶作用之外,即使在低于-78°C也会导致加成反应的极端加速。
P4-t-Bu具有极高的碱度和低的亲核性,这归功于其非常高的空间位阻以及许多供体基团与质子化形成的阳离子的需要空间的结构共轭的参与。
P4-t-Bu是一种吸湿性极强的固体,热稳定性高达120 °C,对(干)氧和碱化学稳定。[9]溴乙烷可以消除痕量的水和质子杂质。该碱既非常亲水又非常亲油,并且可以通过形成微溶的四氟硼酸盐方便且几乎完全地从反应混合物中回收。
由于其极弱的路易斯碱度,P4-t-Bu的阳离子可抑制金属有机基团的典型副反应(如羟醛缩合),这可能由氨基锂如二异丙氨基锂(LDA)引起[11]
应用
[编辑]如果中性超强碱P4-t-Bu对氧化或副反应(如酰化)敏感,则它们会导致溶解度问题或路易斯酸催化的副反应(如醛醇反应、环氧开环等)。
它可以与正烷基溴化物脱卤产生烯烃,例如 1-溴辛烷与P4-t-Bu的反应在温和条件下几乎定量 (96%)产生1-辛烯,叔丁醇钾/18-冠-6系统收率仅为75%。[12]
弱酸性亚甲基上的烷基化(例如在羧酸酯或腈的情况下)以高产率和选择性进行。例如,在P4-t-Bu存在下,通过8-苯基甲基苯基乙酸酯与碘乙烷的反应,可以以95%的产率获得Z构型的单乙基衍生物。[13]
丁二腈与碘乙烷在 P4-t-Bu存在下以 98% 的产率反应生成四乙基衍生物,而无需经历索普-齐格勒反应以形成环状α-酮腈。[9]
使用惰性氟仿(HFC-23)在 P4-t-Bu和三(三甲基甲硅烷基)胺存在下,酮(如二苯甲酮)的三氟甲基化也可以在室温下以高达84%的良好收率进行。[14]
在没有金属催化剂的温和条件下,在 P4-t-Bu 存在下,邻炔基苯基醚的分子内环化取代苯并呋喃。[15]
由于它的极端碱性,早期有人建议P4-t-Bu适合作为阴离子聚合的引发剂。使用乙酸乙酯/P4-t-Bu引发剂体系,可以在THF中获得多分散性窄、摩尔质量高达40,000 g·mol-1的聚甲基丙烯酸甲酯(PMMA)。[11]
环氧乙烷与引发剂体系正丁基锂/P4-t-Bu的阴离子聚合产生具有低多分散性的明确定义的聚环氧乙烷。[16]
环状硅氧烷(如六甲基环三矽氧烷或十甲基环五矽氧烷)也可以在良好的分子量控制下,以催化量的P4-t-Bu和水或矽烷醇作为引发剂,聚合成分解温度>450 °C的热非常稳定的聚矽氧烷。[3][17]由于P4-t-Bu具有极高的碱性,它会急切地吸收水和二氧化碳,这两者都会抑制阴离子聚合。加热到温度 >100 °C时去除 CO2和水并恢复阴离子聚合。磷腈碱P4-t-Bu作为一种物质和在溶液中的极端吸湿性要求在储存和处理方面付出巨大努力,并阻碍其更广泛的使用。
参考
[编辑]- ^ R. Schwesinger; et al, Wie stark und wie gehindert können ungeladene Phosphazene sein?, Angew. Chem., 1993, 105 (9): 1420–1422, doi:10.1002/ange.19931050940 (德语)
- ^ 2.0 2.1 2.2 2.3 R. Schwesinger; et al, Extremely strong, uncharged auxiliary bases; Monomeric and polymer-supported polyaminophosphazenes (P2-P5), Liebigs Ann. Chem., 1996, 7: 1055–10081, doi:10.1002/jlac.199619960705
- ^ 3.0 3.1 6353075
- ^ J. Saame; et al, Experimental basicities of superbasic phosphonium ylides and phosphazenes, J. Org. Chem., 2016, 81 (17): 7349–7361, doi:10.1021/acs.joc.6b00872
- ^ E.D. Nacsa; T.H. Lambert, Higher-order cyclopropenimine superbases. Direct neutral Bronsted base catalyzed Michael reactions with α-aryl esters, J. Am. Chem. Soc., 2015, 137 (32): 10246–10253, PMC 4617652
 , PMID 26131761, doi:10.1021/jacs.5b05033
, PMID 26131761, doi:10.1021/jacs.5b05033
- ^ V. Gupta, New synthetic methods for biologically active aromatic heterocycles, Ames, Iowa: Iowa State University, 2010[永久失效链接]
- ^ 0921128
- ^ R. Schwesinger; J. Willaredt; H. Schlemper; M. Keller; D. Schmitt; H. Fritz, Novel, Very Strong, Uncharged Auxiliary Bases; Design and Synthesis of Monomeric and Polymer-Bound Triaminoiminophosphorane Bases of Broadly Varied Steric Demand, Chem. Ber., 1994, 127 (12): 2435–2454, doi:10.1002/cber.19941271215
- ^ 9.0 9.1 9.2 R. Schwesinger; Y. Kondo, Phosphazene Base P4-t-Bu, e-EROS Encyclopedia of Reagents for Organic Synthesis, 2010, doi:10.1002/047084289X.rp150.pub2
- ^ 10.0 10.1 Strong and Hindered Bases in Organic Syntheses. Sigma-Aldrich. [2016-12-20]. (原始内容 (PDF; 1,2 MB)存档于2017-06-21).
- ^ 11.0 11.1 T. Pietzonka, D. Seebach, Die P4-Phosphazenbase als Teil eines metallfreien Initiatorsystems für die anionische Polymerisation von Methacrylsäuremethylester, Angew. Chem., 1993, 105 (5): 741–742, doi:10.1002/ange.19931050514 (德语)
- ^ R. Schwesinger; H. Schlemper, Peralkylierte Polyaminophosphazene – extrem starke neutrale Stickstoffbasen, Angew. Chem., 1987, 99 (11): 1212–1214, doi:10.1002/ange.19870991134 (德语)
- ^ A. Solladié-Cavallo; A.G. Csaky; I. Gantz; J. Suffert, Diastereoselective Alkylation of 8-Phenylmenthyl Phenylacetate: Aggregated Lithium Enolate versus "Naked" Enolate, J. Org. Chem., 1994, 59 (18): 5343–5346, doi:10.1021/jo00097a041
- ^ S. Okusu; K. Hirano; E. Tokunaga; N. Shibata, Organocatalyzed trifluormethylation of ketones and sulfonyl fluorides by fluoroform under a superbase system, ChemistryOpen, 2015, 4: 581–585, PMC 4608523
 , PMID 26491635, doi:10.1002/open.201500160
, PMID 26491635, doi:10.1002/open.201500160
- ^ C. Kanazawa; K. Goto; M. Terada, Phosphazene base-catalyzed intramolecular cyclization for efficient synthesis of benzofurans via carbon-carbon bond formation, Chem. Commun., 2009, (35): 5248–5250, doi:10.1039/B913588J
- ^ B. Eßwein; M. Möller, Polymerisation von Ethylenoxid mit Alkyllithiumverbindungen und der Phosphazenbase "t Bu-P4", Angew. Chem., 1996, 108 (6): 703–705, doi:10.1002/ange.19961080620 (德语)
- ^ P.C. Hupfield; R.G. Taylor, Ring-opening polymerisation of siloxanes using phosphazene base catalysts, J. Inorg. Organomet. Polym. Mater., 1999, 9 (1): 17–34, doi:10.1023/A:1021429320083

![{\displaystyle {\ce {[(R_{2}^{1}N)_{3}P=N-]_{\mathit {x}}-(R_{2}^{1}N)_{3\!-{\mathit {x}}}P=NR2}}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/dd5464ed17d043fbe22eb8eb03446d3211ce9119)
![{\displaystyle {\begin{matrix}{}\\\underbrace {\ce {PCl5}} _{(1)}\ {\ce {->[{\ce {Me2NH}}]}}\underbrace {\left[{\ce {(Me2N)3{\overset {\oplus }{P}}-Cl.{\overset {\ominus }{C}}l}}\right]} _{(2)}\ {\ce {->[1.\ {\ce {NH3}}][2.\ {\ce {NaBF4}}]}}\ \underbrace {\ce {(Me2N)3{\overset {\oplus }{P}}-NH2.{\overset {\ominus }{B}}F4}} _{(3)}\\{}\end{matrix}}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/934831033e3d3a948ab3ad1435b54d3955156102)
![{\displaystyle \underbrace {\ce {(Me2N)3{\overset {\oplus }{P}}-NH2.{\overset {\ominus }{B}}F4}} _{(3)}\ {\ce {->[{\ce {KOMe}}]}}\ \underbrace {\ce {(Me2N)3P=NH}} _{(4)}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/f770d8ef6ebd14dd05f206b5a5834c39af323aaf)
![{\displaystyle \underbrace {\ce {PCl5}} _{(1)}\ {\ce {->[t{\text{-}}{\ce {Bu-{\overset {\oplus }{NH3}}.{\overset {\ominus }{Cl}}}}]}}\ \underbrace {t{\text{-}}{\ce {Bu-N=PCl3}}} _{(5)}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/d9273434d7f39954c83fec9f0e179ee064ad1afe)
![{\displaystyle \scriptstyle {\begin{matrix}{}\\\underbrace {\ce {7(Me2N)3P=NH}} _{(4)}\ +\ \underbrace {t{\text{-}}{\ce {Bu-N=PCl3}}} _{(5)}\ {\ce {->}}\ \underbrace {{\ce {[(Me2N)3P=N]3P=N{\overset {\oplus }{H}}-}}t{\text{-}}{\ce {Bu.{\overset {\ominus }{Cl}}}}} _{(6)}\ {\ce {->[{\ce {NaBF4}}]}}\ \underbrace {{\ce {[(Me2N)3P=N]3P=N{\overset {\oplus }{H}}-}}t{\text{-}}{\ce {Bu.{\overset {\ominus }{B}}F4}}} _{(7)}\ {\ce {->[{\ce {KOMe/NaNH2}}]}}\ \underbrace {{\ce {[(Me2N)3P=N]3P=N{\overset {\oplus }{H}}-}}t{\text{-}}{\ce {Bu}}} _{(8)}\\{}\end{matrix}}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/480a005659a30c7e3dd9eea70be5e9723311a768)