鹵化
鹵化(Halogenation)是一种化工单元过程,指的是將有机化合物分子中引入卤素原子,最常用的是向烃分子中引入卤素原子,形成“卤烃”,由于卤烃相当活泼,很容易被其他原子或“基”置换,因此常用于有机合成制造中间体的过程。鹵化也可以指無機化合物(例如金屬)引入卤素原子的过程。
鹵化的途徑和化學劑量和其化學結構的特性、有機化合物的官能基或鹵化的鹵族元素都有關係。卤素是氟、氯、溴、碘、砹五种元素的总称,因此卤化也分为氟化、氯化、溴化和碘化。碘比氯和溴要贵上很多,因而化工生产中最常用的是氯化法和溴化法。常用的氯化剂是氯气或氯化氢。因为氟气氧化性太强,通常会将反应物直接氧化分解,因而氟化一般用相应的氟化剂。
鹵化的例子有乙炔被氯化氢氯化,可以生成氯乙烯,成为制造塑料聚氯乙烯的原料;苯被氯化生成六氯苯等。
脫鹵反應(Dehalogenation)是鹵化的逆反應,就是從分子中移除鹵族元素,最常見的是脫鹵化氫反應[1]。
有機化合物的鹵化: 各種類的反應
[编辑]有機化合物鹵化有很多反應途徑,包括自由基鹵化、酮基鹵化、親電子鹵化和鹵化加成反應。
自由基鹵化
[编辑]典型的飽和碳氫化合物(烷、環烷)透過自由基鹵化,藉由鹵族元素取代氫原子。鹵化烷類在區域化學上常常被決定於相對可使用較弱的C-H鍵結。這反應傾向二級和三級碳的位置,因愈穩定的結構愈會導致自由基和躍遷能階產生反應。自由基鹵化被使用在工業製造甲烷氯化物。[2]
- CH4 + Cl2 → CH3Cl + HCl
- RCH=CHR'(烯)+ X2(鹵素)→ RCHX-CHXR'
- RC≡CR(炔)+ 2X2(鹵素) → RCHX-CHXR'
烯類的加成鹵化會產生中間產物鹵離子。特別地,這個中間產物可以把它分離出來。 [3]
芳香化合物的鹵化
[编辑]芳香化合物的鹵化是親電子的鹵化反應:[4]
- RC6H5 + X2 → HX + RC6H4X
此鹵化機制受鹵族元素的影響,氟和氯比較有親電的特性以及為比較強的鹵化劑,溴跟氟和氯比起來是比較弱的鹵化劑,但碘是它們當中反應最弱的。此脫氫鹵化的機制遵循反轉趨勢:碘是最容易從有機物中移除而有機氟化物則有最高穩定度。
其他鹵化方法
[编辑]- 汉斯狄克反应:從羧酸中提出短鍊鹵化物,其第一個會產生銀鹽,其之後會和鹵族元素氧化:
- RCO2Ag + Br2 → RBr + CO2 + AgBr
- 桑德迈尔反应:從芳香鹵化物重氮鹽中得到,此化合物是從苯胺中得到。
- 赫尔-乌尔哈-泽林斯基反应:羧酸中的α上碳進行鹵化。
有機化合物的鹵化:依鹵族元素歸類
[编辑]氟化
[编辑]氟和飽和或不飽和的有機化合物反應,反應快速,容易爆炸。此反應需要在專業環境下進行。實際應用中,有機化合物常用電化學進行鹵化。最近發現可用氟化氫在阴极當作氟的來源,這方法叫作電化學氟化(ECF)。除了用電化學產生氟,還有各種氟化試劑的應用像是二氟化氙和氟化鈷。
氯化
[编辑]氯化會產生放熱反應。所有的飽和或不飽和化合物會和氯直接產生反應。此組成常需要紫外光幫忙裂解氯原子。氯化在工業上常用來製造1,2 - 二氯乙烷(PVC)還有當作溶劑的乙烷。另一種是用氯化氫和氧結合進行氧氯化,此效果必直接氯化(利用Cl2)來的好。 [2]
氧氯化
[编辑]氧氯化是混合氯化氫和氧(O2)讓碳氫化合物氯化,這個方法工業上很愛用因為氯化氫比氯便宜。[5]烯是最常用的反應物:
- CH2=CH2 + 2 HCl + ½ O2 → ClCH2CH2Cl + H2O
此反應一開始由氯化銅(CuCl2 ,一種從1,2-二氯乙烷產生的催化劑),有時候氯化銅會在二氧化矽中做為助催化劑幫助產生氯化鉀、氯化鑭或氯化鋁。除了二氧化矽,也可以用礬土、矽藻土或浮石作為輔助反應。因為這些反應會放出高能量(238 kJ/mol) ,催化溫度上得受到控制以免熱裂解。催化對於碳氫化合物的雙鍵氯化扮演很重要的角色,因為氯化銅是其中提供氯原子雙鍵的化合物之一。反應式如下:
- CH2=CH2 + 2 CuCl2 → 2 CuCl + ClH2C-CH2Cl
氯化銅依序會由氯化亞銅和氧反應再來和氯化氫反應而產生:
- ½ O2 + 2 CuCl → CuOCuCl2
- 2 HCl + CuOCuCl2 → 2 CuCl2 + H2O
氧氯化在製造1,2 - 二氯乙烷方面是很重要的,之後可以做出氯乙烯,其反應式如下:
- ClCH2CH2Cl → CH2=CHCl + HCl
- 2 HCl + CH2=CH2 + ½ O2 → ClCH2CH2Cl + H2O
氯化氫由以上步驟循環反應進行氧氯化,反應物會自己產生也是工業上愛用氧氯化而不是氯化的原因。[6]
溴化
[编辑]溴化比氯化還具有選擇性因為反應放出的能量比較少,一般的溴化是加成Br2到烯類上面,自然界中比較常有飽和碳氫化合物和芳香化合物的溴化,形成有機溴化化合物。常用的催化劑是溴過氧化物酶,其是利用溴和氧的結合形成氧化劑。
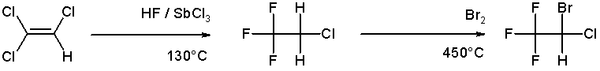
在三氯乙烯中進行有機合成製造麻醉劑氟烷即為溴化的一個例子: [7]
有機溴化合物是自然界中最常見的鹵化化合物,它的形成是透過溴過氧化物酶進行催化。海洋被估計每年會释放1-2百萬噸的溴仿和56,000噸的溴甲烷。[8]
碘化
[编辑]碘是反應最弱的鹵化物,最难和大部分的有機化合物反應。碘与烯類加成是用一種分析的方法叫作碘質,它是用來測量脂肪的不飽和程度的一種方法。碘仿反應包刮會降解甲基酮。
無機化學
[编辑]除了氬、氖、氦以外的元素都會直接和氟反應形成氟化物。氯的選擇性較強,但仍可以和大部分的金屬元素和較重的非金屬元素反應。按照趨勢,溴的活性較弱,而碘的活性最弱。可能的反應像金的氯化產生氯化金。在工業上金屬直接氯化較不重要,因為比較容易金屬氧化物和鹵化氫反應來進行鹵化。像三氯化磷和一氯化硫的生產,是較大規模直接進行無機化合物鹵化的例子[9]。
另見
[编辑]參考文獻
[编辑]- ^ Yoel Sasson "Formation of Carbon–Halogen Bonds (Cl, Br, I)" in Patai's Chemistry of Functional Groups, 2009, Wiley-VCH, Weinheim. doi:10.1002/9780470682531.pat0011
- ^ 2.0 2.1 M. Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2
- ^ T. Mori, R. Rathore. X-Ray structure of bridged 2,2'-bi(adamant-2-ylidene) chloronium cation and comparison of its reactivity with a singly bonded chloroarenium cation. Chem. Commun. 1998, (8): 927–928. doi:10.1039/a709063c.
- ^ Illustrative procedure for chlorination of an aromatic compound: Edward R. Atkinson, Donald M. Murphy, and James E. Lufkin (1951). "dl-4,4',6,6'-Tetrachlorodiphenic Acid". Org. Synth.; Coll. Vol. 4: 872.
- ^ Marshall, K. A. 2003. Chlorocarbons and Chlorohydrocarbons, Survey. Kirk-Othmer Encyclopedia of Chemical Technology
- ^ "Oxy | Oxychlorination." Oxy | Oxychlorination. N.p., n.d. Web. 10 Oct. 2012. [1] (页面存档备份,存于互联网档案馆)
- ^ Synthesis of essential drugs, Ruben Vardanyan, Victor Hruby; Elsevier 2005 ISBN 0-444-52166-6
- ^ Gordon W. Gribble “The diversity of naturally occurring organobromine compounds” Chemical Society Reviews, 1999, volume 28, pages 335 – 346.doi:10.1039/a900201d
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).