二硫:修订间差异
小 →性質: 我找到的來源説是1556 // Edit via Wikiplus |
小 →性質: en:User_talk:Smokefoot#the_S-S_bond_energy 原創研究或原創總結風險,移除。 |
||
| 第134行: | 第134行: | ||
然而三重態的二硫難以轉換成S<sub>8</sub><ref name="startsev2019diatomic"/>。也就是說,一般的情況下,硫加熱到足夠溫度有機會轉變成S<sub>2</sub>,而S<sub>2</sub>分子冷卻後一般轉變為环八硫,如影片所示,其中玻璃管上方凝结下的黄色固体就是环八硫。<ref>无机化学丛书 第五卷 氧 硫 硒分族. pp 164</ref> |
然而三重態的二硫難以轉換成S<sub>8</sub><ref name="startsev2019diatomic"/>。也就是說,一般的情況下,硫加熱到足夠溫度有機會轉變成S<sub>2</sub>,而S<sub>2</sub>分子冷卻後一般轉變為环八硫,如影片所示,其中玻璃管上方凝结下的黄色固体就是环八硫。<ref>无机化学丛书 第五卷 氧 硫 硒分族. pp 164</ref> |
||
基態的二硫处于[[三重态]],即帶有兩個不成對的電子的雙自由基,類似於氧氣分子和一氧化硫分子。二硫分子中的S-S鍵長約為189 pm,比{{化學式|硫|8}}分子中的S-S鍵長206 pm還短一些。 其在[[拉曼光譜學|拉曼光譜]]中,S-S鍵的譜線位於715 cm<sup>−1</sup>處<ref>{{Cite book| last1 = Eckert | first1 = Bodo| last2 = Steudel | first2 = Ralf| chapter = Molecular Spectra of Sulfur Molecules and Solid Sulfur Allotropes | doi = 10.1007/b13181 | title = Elemental Sulfur and Sulfur-Rich Compounds II | series = [[Topics in Current Chemistry]] | volume = 231 | pages = 181–191| year = 2003 | isbn = 978-3-540-40378-4 | pmid = | pmc = }}</ref>,而在氧氣分子的O-O鍵對應的譜線位於1556 cm<sup>−1</sup><ref>{{Cite journal|last=Hill|first=R.A.|last2=Esherick|first2=P.|last3=Owyoung|first3=A.|date=1983|title=High-resolution stimulated Raman spectroscopy of O2|url=|journal=Journal of Molecular Spectroscopy|language=en|volume=100|issue=1|pages=119–133|doi=10.1016/0022-2852(83)90029-2|via=}}</ref> |
基態的二硫处于[[三重态]],即帶有兩個不成對的電子的雙自由基,類似於氧氣分子和一氧化硫分子。二硫分子中的S-S鍵長約為189 pm,比{{化學式|硫|8}}分子中的S-S鍵長206 pm還短一些。 其在[[拉曼光譜學|拉曼光譜]]中,S-S鍵的譜線位於715 cm<sup>−1</sup>處<ref>{{Cite book| last1 = Eckert | first1 = Bodo| last2 = Steudel | first2 = Ralf| chapter = Molecular Spectra of Sulfur Molecules and Solid Sulfur Allotropes | doi = 10.1007/b13181 | title = Elemental Sulfur and Sulfur-Rich Compounds II | series = [[Topics in Current Chemistry]] | volume = 231 | pages = 181–191| year = 2003 | isbn = 978-3-540-40378-4 | pmid = | pmc = }}</ref>,而在氧氣分子的O-O鍵對應的譜線位於1556 cm<sup>−1</sup><ref>{{Cite journal|last=Hill|first=R.A.|last2=Esherick|first2=P.|last3=Owyoung|first3=A.|date=1983|title=High-resolution stimulated Raman spectroscopy of O2|url=|journal=Journal of Molecular Spectroscopy|language=en|volume=100|issue=1|pages=119–133|doi=10.1016/0022-2852(83)90029-2|via=}}</ref>。 |
||
單重態的二硫能以亞穩態存在,實驗表明高溫下二硫從單重態轉變為三重态的過程不容易或十分緩慢<ref>{{cite journal|journal=Журнал физической химии|volume=88|issue=6|language=ru|issn=0044-4537|date=2014|pages=943–956|doi=10.7868/S004445371406034X|url=http://elibrary.ru/item.asp?doi=10.7868/S004445371406034X|title=Особенности низкотемпературного каталитического разложения сероводорода|accessdate=2020-05-07|author=А. Н. Старцев, О. В. Круглякова, С. Ф. Рузанкин, Н. Н. Булгаков, Ю. А. Чесалов, Е. А. Кравцов, В. И. Жейвот, Т. В. Ларина, Е. А. Паукштис}}</ref><ref name=startsev2015reaction>{{cite journal |
單重態的二硫能以亞穩態存在,實驗表明高溫下二硫從單重態轉變為三重态的過程不容易或十分緩慢<ref>{{cite journal|journal=Журнал физической химии|volume=88|issue=6|language=ru|issn=0044-4537|date=2014|pages=943–956|doi=10.7868/S004445371406034X|url=http://elibrary.ru/item.asp?doi=10.7868/S004445371406034X|title=Особенности низкотемпературного каталитического разложения сероводорода|accessdate=2020-05-07|author=А. Н. Старцев, О. В. Круглякова, С. Ф. Рузанкин, Н. Н. Булгаков, Ю. А. Чесалов, Е. А. Кравцов, В. И. Жейвот, Т. В. Ларина, Е. А. Паукштис}}</ref><ref name=startsev2015reaction>{{cite journal |
||
2020年5月9日 (六) 17:59的版本
| 二硫 | |
|---|---|
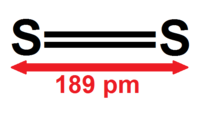
| |

| |
| IUPAC名 Disulfur | |
| 别名 | 双原子硫 二聚硫 |
| 识别 | |
| CAS号 | 23550-45-0 |
| PubChem | 5460602 |
| ChemSpider | 4574100 |
| SMILES |
|
| Gmelin | 753 |
| ChEBI | 29387 |
| 性质 | |
| 化学式 | S2 |
| 摩尔质量 | 64.13 g·mol−1 |
| 偶极矩 | 0 D |
| 热力学 | |
| ΔfHm⦵298K | 128.60 kJ mol−1 |
| S⦵298K | 228.17 J K−1 mol−1 |
| 热容 | 32.51 kJ K−1 mol−1 |
| 相关物质 | |
| 相关化学品 | Triplet oxygen |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
二硫又稱雙原子硫,是一種由硫構成的双原子分子,其化學式為S2[1]。 二硫是結構最簡單的硫分子[2]。其與氧氣分子結構類似,但在室溫下不易存在,是一個不穩定分子,並具有高反應性[2],其為含硫物質燃燒過程中重要的活性中間體[3]。這種物質在高溫低壓下的外觀為藍紫色氣體[4],並且為熱硫蒸氣中的主要成分之一。這種氣體是木卫一大氣的次要成分之一[5]。
合成
二硫为硫的双原子分子。在720°C,硫主要以二硫存在,當溫度達1000°C時,硫蒸氣就幾乎是由二硫組成[6]。在530°C、低壓(1毫米水銀)的環境中,二硫佔硫蒸汽的99%。火焰中產生的S2分子使硫燃燒時呈藍色。[7]。
二硫也可以透過將硫化氫加熱至1000°C制得[6]:
在鉑催化劑下,二硫亦能在室溫下生成[6]:
而大氣中的羰基硫在水銀光敏感劑的作用下照射紫外光也能生成二硫。二硫化碳(CS2)、過硫化氫(H2S2)、二氯化二硫(S2Cl2)、環硫乙烷(C2H4S)、硫代磷醯氟(PSF3)或羰基硫(COS)的光分解也會生成二硫[8]。
自然存在

儘管在地球上常溫環境二硫無法穩定存在,然而在其他行星的衛星上有檢測到二硫的存在,例如其為木卫一上大氣的次要成分[5],且在該行星的貝利火山噴出的氣體中有檢測到二硫氣體的存在[9]。在行星大氣化學中,二硫也是為含硫物質燃燒過程中重要的活性中間體[3],例如苏梅克-列维9号彗星撞擊木星後[10],在木星的大氣中檢測到了二硫分子[9],而在一些彗星的大氣[11][12][13]或分子雲[14][15]的光譜中亦檢測到了二硫分子的譜線。
性質
硫蒸氣中可能的硫分子包括了二硫、三硫、四硫、五硫、六硫和八硫等,溫度越高,二硫在硫蒸氣中佔的比例就越高,直到溫度高於1000°C時,此時硫蒸氣幾乎由二硫組成[6]。在800°C、氣壓1毫米汞柱條件下二硫的外觀為藍紫色氣體[4]。
二硫是氧氣分子的等电子体[6],然而它與其他雙原子分子較不同之處為其基態為三重态且第一激發態的能量更高[16]。常溫下的硫蒸汽是多種硫分子和自由基所組成,隨著溫度提升低分子量的硫分子(如二硫、三硫)才會逐漸增加,但仍然是混合物,直到700°C以上二硫才會達到99%以上,這使的對二硫的研究必須在高溫下進行,導致對二硫得實驗和觀測有較高的難度[6]。
然而,其與氧分子不同,高溫下的二硫分子冷卻到室溫後更傾向於凝聚成固態的S8,而不是轉變成三重態的二硫分子。因此透過加熱生成的二硫分子冷卻至室溫時不會保留二硫分子的形式[6]。
然而三重態的二硫難以轉換成S8[6]。也就是說,一般的情況下,硫加熱到足夠溫度有機會轉變成S2,而S2分子冷卻後一般轉變為环八硫,如影片所示,其中玻璃管上方凝结下的黄色固体就是环八硫。[17]
基態的二硫处于三重态,即帶有兩個不成對的電子的雙自由基,類似於氧氣分子和一氧化硫分子。二硫分子中的S-S鍵長約為189 pm,比S8分子中的S-S鍵長206 pm還短一些。 其在拉曼光譜中,S-S鍵的譜線位於715 cm−1處[18],而在氧氣分子的O-O鍵對應的譜線位於1556 cm−1[19]。
單重態的二硫能以亞穩態存在,實驗表明高溫下二硫從單重態轉變為三重态的過程不容易或十分緩慢[20][21][22]。在1000°C的環境下,即使有鉑催化劑存在,該反應也不會加速。[6]而單重態的二硫從高穩冷卻後會轉變成S8[6],是硫的一種同素異形體。硫有多約30種的同素異形體,其特性可以透過其光譜型來區分,在一般條件下,硫最穩定的同素異形體是S8[23]。二硫相對來說顯得不太穩定。此外,二硫容易光分解[3]。在太陽光下,二硫的半衰期約為7.5分鐘[11]。
參見
參考文獻
- ^ Steudel, Ralf; Eckert, Bodo. Solid Sulfur Allotropes. Elemental Sulfur and Sulfur-Rich Compounds I. Topics in Current Chemistry 230. 2003: 58–68. ISBN 978-3-540-40191-9. doi:10.1007/b12110.
- ^ 2.0 2.1 Andrzej Z. Rys and Erwin K.V. Schultz and David N. Harpp. Quest for diatomic selenium. Journal of Sulfur Chemistry (Taylor & Francis). 2010, 31 (5): 351–371. doi:10.1080/17415993.2010.513440.
- ^ 3.0 3.1 3.2 Frederix, Pim W. J. M.; Yang, Chung-Hsin; Groenenboom, Gerrit C.; Parker, David H.; Alnama, Koutayba; Western, Colin M.; Orr-Ewing, Andrew J. Photodissociation Imaging of Diatomic Sulfur (S2)†. The Journal of Physical Chemistry A. 2009, 113 (52): 14995–15005. Bibcode:2009JPCA..11314995F. ISSN 1089-5639. PMID 19754091. doi:10.1021/jp905104u.
- ^ 4.0 4.1 Macintyre, J.E. Dictionary of Inorganic Compounds. Taylor & Francis. 1992. ISBN 9780412301209.
- ^ 5.0 5.1 Lellouch, E. Io's Atmosphere and Surface-Atmosphere Interactions. Space Science Reviews. January 2005, 116 (1–2): 211–224. Bibcode:2005SSRv..116..211L. doi:10.1007/s11214-005-1957-z.
- ^ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 Startsev, AN. Diatomic sulfur: a mysterious molecule. Journal of Sulfur Chemistry (Taylor & Francis). 2019, 40 (4): 435––450.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Tardif, Sylvie L.; Rys, Andrzej Z.; Abrams, Charles B.; Abu-Yousef, Imad A.; Lesté-Lasserre, Pierre B. F.; Schultz, Erwin K. V.; Harpp, David N. Recent chemistry of the chalcogen diatomics. Tetrahedron. 1997, 53 (36): 12225–12236. doi:10.1016/S0040-4020(97)00555-3.
- ^ 9.0 9.1 Spencer, J. R. Discovery of Gaseous S2 in Io's Pele Plume. Science. 2000, 288 (5469): 1208–1210. Bibcode:2000Sci...288.1208S. ISSN 0036-8075. PMID 10817990. doi:10.1126/science.288.5469.1208.
- ^ Noll, KS and McGrath, MA and Trafton, Laurence M and Atreya, SK and Caldwell, JJ and Weaver, HA and Yelle, RV and Barnet, C and Edgington, S. HST spectroscopic observations of Jupiter after the collision of comet Shoemaker-Levy 9. Science (American Association for the Advancement of Science). 1995, 267 (5202): 1307––1313.
- ^ 11.0 11.1 Ahearn, M. F.; Schleicher, D. G.; Feldman, P. D. The discovery of S2 in comet IRAS-Araki-Alcock 1983d. The Astrophysical Journal. 1983, 274: L99. Bibcode:1983ApJ...274L..99A. ISSN 0004-637X. doi:10.1086/184158.
- ^ Grim, RJA and Greenberg, JM; et al. Photoprocessing of H2S in interstellar grain mantles as an explanation for S2 in comets. Astronomy and Astrophysics. 1987, 181: 155––168.
- ^ Kim, Sang J and A'Hearn, Michael F and Larson, Stephen M. Multi-cycle fluorescence: Application to S2 in comet IRAS-Araki-Alcock 1983VII. Icarus (Elsevier). 1990, 87 (2): 440––451.
- ^ Liszt, HS. Upper limits on the abundance of the sulfur dimer in molecular clouds. The Astrophysical Journal. 1978, 219: 454––457.
- ^ Mitchell, GF. Effects of shocks on the sulfur chemistry of a dense interstellar cloud. The Astrophysical Journal. 1984, 287: 665––670.
- ^ Swope, William C and Lee, Yuan-Pern and Schaefer III, Henry F. Diatomic sulfur: Low lying bound molecular electronic states of S2. The Journal of Chemical Physics (American Institute of Physics). 1979, 70 (2): 947––953.
- ^ 无机化学丛书 第五卷 氧 硫 硒分族. pp 164
- ^ Eckert, Bodo; Steudel, Ralf. Molecular Spectra of Sulfur Molecules and Solid Sulfur Allotropes. Elemental Sulfur and Sulfur-Rich Compounds II. Topics in Current Chemistry 231. 2003: 181–191. ISBN 978-3-540-40378-4. doi:10.1007/b13181.
- ^ Hill, R.A.; Esherick, P.; Owyoung, A. High-resolution stimulated Raman spectroscopy of O2. Journal of Molecular Spectroscopy. 1983, 100 (1): 119–133. doi:10.1016/0022-2852(83)90029-2 (英语).
- ^ А. Н. Старцев, О. В. Круглякова, С. Ф. Рузанкин, Н. Н. Булгаков, Ю. А. Чесалов, Е. А. Кравцов, В. И. Жейвот, Т. В. Ларина, Е. А. Паукштис. Особенности низкотемпературного каталитического разложения сероводорода. Журнал физической химии. 2014, 88 (6): 943–956 [2020-05-07]. ISSN 0044-4537. doi:10.7868/S004445371406034X (俄语).
- ^ Startsev, AN and Bulgakov, NN and Ruzankin, S Ph and Kruglyakova, OV and Paukshtis, EA. The reaction thermodynamics of hydrogen sulfide decomposition into hydrogen and diatomic sulfur. Journal of Sulfur Chemistry (Taylor & Francis). 2015, 36 (3): 234––239.
- ^ A. N. Startsev. Low-temperature catalytic decomposition of hydrogen sulfide into hydrogen and diatomic gaseous sulfur. Kinetics and Catalysis. 2016-07, 57 (4): 511–522 [2020-05-07]. ISSN 0023-1584. doi:10.1134/S002315841604011X (英语).
- ^ A. F. Holleman, N. Wiberg. Inorganic Chemistry. Academic Press; Berlin; New York: De Gruyter, 2001.ISBN 0-12-352651-5

![{\displaystyle {\ce {2H2S<=>[\Delta {\text{ T}}]2{H2}+{^{1}S2_{(gas)}}}}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/ea5aa4b4904e79738ccf86409623b2b65e9a964a)
![{\displaystyle {\ce {2H2S->[{\text{metal, RT}}]2{H2}+{^{3}S2_{(gas)}}}}}](https://wikimedia.org/zhwiki/api/rest_v1/media/math/render/svg/2ee50ea164a2c126ead6a27c4951e3ce6fa054ae)


