1,8-octanodiamina
| 1,8-octanodiamina | ||
|---|---|---|
|
| ||
 | ||
| Nombre IUPAC | ||
| Octano-1,8-diamina | ||
| General | ||
| Otros nombres |
1,8-diaminooctano Octametilendiamina 1,8-octilendiamina | |
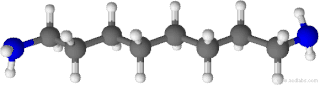
| Fórmula semidesarrollada | NH2-(CH2)8-NH2 | |
| Fórmula molecular | C8H20N2 | |
| Identificadores | ||
| Número CAS | 373-44-4[1] | |
| Número RTECS | RG8841500 | |
| ChEBI | 73112 | |
| ChEMBL | CHEMBL29392 | |
| ChemSpider | 22672 | |
| DrugBank | DB04333 | |
| PubChem | 24250 | |
| UNII | 53A6694PIE | |
|
C(CCCCN)CCCN
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 980 kg/m³; 0,98 g/cm³ | |
| Masa molar | 14 426 g/mol | |
| Punto de fusión | 50 °C (323 K) | |
| Punto de ebullición | 225 °C (498 K) | |
| Presión de vapor | 0,0 ± 0,5 mmHg | |
| Índice de refracción (nD) | 1,462 | |
| Propiedades químicas | ||
| Solubilidad en agua | 575 g/L (20 °C) | |
| log P | 1,10 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 388,15 K (115 °C) | |
| Temperatura de autoignición | 558,15 K (285 °C) | |
| Límites de explosividad | 1,1% - 6,8% | |
| Compuestos relacionados | ||
| aminas |
1-octanamina Octodrina Dibutilamina | |
| diaminas |
1,7-heptanodiamina N,N,N'-trietil-1,2-etanodiamina Novoldiamina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La 1,8-octanodiamina es un compuesto orgánico de fórmula molecular C8H20N2. Es una diamina lineal de ocho átomos de carbono con dos grupos amino primarios en los extremos. Recibe también los nombres de 1,8-diaminooctano, octametilendiamina, 1,8-octilendiamina y, en nomenclatura IUPAC, octano-1,8-diamina.[2]
Propiedades físicas y químicas
[editar]A temperatura ambiente, la 1,8-octanodiamina es un sólido blanco o de color amarillo pálido con el aspecto de una masa cristalina.[3] Tiene su punto de fusión a 50 - 52 °C y su punto de ebullición a 225 °C. Su densidad es ligeramente inferior a la del agua (ρ = 0,98 g/cm³) y es soluble en ella, en proporción de 575 g/L (a 20 °C). El valor del logaritmo de su coeficiente de reparto, logP = 1,10, indica que su solubilidad en disolventes apolares —como el 1-octanol— es mayor que en agua.[4]
Este compuesto es sensible al aire e higroscópico. Es incompatible con agentes oxidantes fuertes[5] y con dióxido de carbono.
Síntesis y usos
[editar]La 1,8-octanodiamina se puede sintetizar haciendo reaccionar el correspondiente diol —1,8-octanodiol— con amoníaco. La reacción se lleva a cabo en fase líquida o supercrítica a una temperatura de 140-170 °C y una presión entre 22 y 40 bar, siendo catalizada por un complejo homogéneo que contiene rutenio.[6]
Esta diamina es, a su vez, intermediario en la síntesis de triacetato de inimoctadina,[3] fungicida aplicado en cítricos antes de la cosecha.
La 1,8-octanodiamina se ha utilizado en la preparación de organogeles híbridos que constan de nanotubos de carbono incorporados a fibras del organogel.[7] También en estructuras híbridas de fulereno C60 y nanopartículas de plata.[8] En esta línea, se ha estudiado esta diamina en relación con el clúster isopolioxotungstato {W36}, el cual proporciona una plataforma molecular inorgánica estable a la que se pueden unir diversas moléculas; la 1,8-octanodiamina, en su forma diprotonada, enlaza dichos clústeres en cadenas infinitas unidimensionales con forma de zig-zag.[9]
Como base junto al ácido úsnico, la 1,8-octanodiamina se ha empleado en la elaboración compuestos citotóxicos, evaluados en células cancerígenas de ratas y humanos por su capacidad de inducir apoptosis.[10]
Precauciones
[editar]La 1,8-octanodiamina es una sustancia combustible cuyo punto de inflamabilidad se alcanza a los 115 °C. Al arder puede emitir productos tóxicos tales como óxidos de nitrógeno. Su temperatura de autoignición es de 285 °C. Es un producto corrosivo que puede ocasionar quemaduras en ojos y piel.[5]
Véase también
[editar]Los siguientes compuestos son isómeros de la 1,8-octanodiamina:
Referencias
[editar]- ↑ Número CAS
- ↑ 1,8-Diaminooctane (PubChem)
- ↑ a b 1,8-Diaminooctane(373-44-4) (Chemical Book)
- ↑ 1,8-diamonooctane (ChemSpider)
- ↑ a b «1,8-Diaminooctane. Safety sheet (Acros Organics).». Archivado desde el original el 16 de agosto de 2016. Consultado el 18 de julio de 2016.
- ↑ Preparation of primary diamines having a linear main chain for polyamide syntheses (2012). Franz-Erich Baumann, Matthias Ullrich, Martin Roos, Peter Hannen, Frank-Martin Petrat, Harald Haeger, Angela Koeckritz, Guido Walther, Jens Deutsch, Andreas Martin. Patente US 20120203033A1.
- ↑ Oh H, Jung BM, Lee HP, Chang JY. (2010). «Dispersion of single walled carbon nanotubes in organogels by incorporation into organogel fibers». J Colloid Interface Sci. 352 (1): 121-127. Consultado el 18 de julio de 2016.
- ↑ Dmitruk NL, Borkovskaya OY, Mamykin SV, Naumenko DO, Berezovska NI, Dmitruk IM, Meza-Laguna V, Alvarez-Zauco E, Basiuk EV. (2008). «Fullerene C60-silver nanoparticles hybrid structures: optical and photoelectric characterization». J Nannosci Nanotechnol. 8 (11): 5958-5965. Consultado el 18 de julio de 2016.
- ↑ McGlone T, Streb C, Long DL, Cronin L. (2009). «Guest-directed supramolecular architectures of {W36} polyoxometalate crowns». Chem Asian J. 4 (10): 1612-1618. Consultado el 18 de julio de 2016.
- ↑ Bazin MA, Le Lamer AC, Delcros JG, Rouaud I, Uriac P, Boustie J, Corbel JC, Tomasi S. (2008). «Synthesis and cytotoxic activities of usnic acid derivatives». Biorg Med Chem. 16 (14): 6860-6866. Consultado el 18 de julio de 2016.
