Acetato de paladio(II)
| Acetato de paladio(II) | ||
|---|---|---|
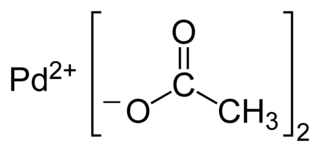 | ||
 | ||
| Nombre IUPAC | ||
| Acetato de paladio(II) | ||
| General | ||
| Otros nombres | Diacetato de paladio | |
| Fórmula semidesarrollada | Pd(CH3COO)2 | |
| Fórmula molecular | PdC4H6O4 | |
| Identificadores | ||
| Número CAS | 3375-31-3[1] | |
| ChemSpider | 146827 | |
| PubChem | 167845 | |
| UNII | 0LTG3460Y5 | |
| Propiedades físicas | ||
| Apariencia | Sólido marrón anaranjado | |
| Densidad | 2190 kg/m³; 2,19 g/cm³ | |
| Masa molar | 22 450 g/mol | |
| Punto de fusión | 205 °C (478 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | poco soluble | |
| Solubilidad | Soluble en disolventes orgánicos | |
| Momento dipolar | 0 D | |
| Peligrosidad | ||
| SGA |
   | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El acetato de paladio(II) es un compuesto químico de paladio descrito por la fórmula [Pd(O2CCH3)2]n, abreviado [Pd(OAc)2]n. Es más reactivo que el compuesto de platino análogo. Dependiendo del valor de n, el compuesto es soluble en muchos disolventes orgánicos y se usa comúnmente como catalizador para reacciones orgánicas.
Estructura
[editar]Con una relación estequiométrica 1:2 de átomos de paladio y ligandos de acetato, el compuesto existe como formas moleculares y poliméricas. El paladio logra una coordinación plano-cuadrada en ambas formas.
Wilkinson y sus compañeros de trabajo lo prepararon en 1965 y luego Skapski y Smart en 1970 lo caracterizaron por difracción de rayos X de un monocristal, el acetato de paladio(II) es un sólido marrón-rojizo que cristaliza en forma monoclínica. Tiene una estructura trimérica, que consiste en un triángulo equilátero de átomos de Pd, cada uno de los cuales está puenteado con dos grupos acetato en una conformación de mariposa.[2][3]
Precursor de otros compuestos de paladio
[editar]El acetato de paladio se usa para producir otros compuestos de paladio(II). Por ejemplo, el acetato de fenilpaladio, usado para isomerizar alcoholes alílicos a aldehídos, se prepara mediante la siguiente reacción:[4]
El acetato de paladio(II) reacciona con acetilacetona (el ligando "acac") para producir Pd(acac)2.
Uso como catalizador
[editar]El acetato de paladio es un catalizador para muchas reacciones orgánicas, especialmente alquenos, dienos y haluros de alquilo, arilo y vinilo para formar aductos reactivos.[5]
Reacciones catalizadas por acetato de paladio (II):
- Vinilación: Un ejemplo es la Reacción de Heck y otras reacciones relacionadas.[6]
- Reordenamiento de dienos acíclicos: un ejemplo es la Transposición de Cope.
- Reacciones de carbonilación: por ejemplo, la formación de ésteres a partir de yoduros de arilo, monóxido de carbono, un alcohol o fenol.[7]
- Aminación reductora de aldehídos y cetonas por formiato potásico.[8]
- Proceso Wacker: oxidación del etileno por agua a acetaldehído (precursor del poli(acetato de vinilo)).
- Aminación de Buchwald-Hartwig de haluros/pseudohaluros de arilo con aminas arílicas o alquílicas.[9][10]
Referencias
[editar]- ↑ Número CAS
- ↑ T. A. Stephenson; S. M. Morehouse; A. R. Powell; J. P. Heffer; G. Wilkinson (1965). «667. Carboxylates of palladium, platinum, and rhodium, and their adducts». Journal of the Chemical Society (Resumed): 3632. doi:10.1039/jr9650003632.
- ↑ Skapski, A C.; M. L. Smart (1970). «The Crystal Structure of Trimeric Palladium(II) Acetate». J. Chem. Soc. D (11): 658b-659. doi:10.1039/C2970000658b.
- ↑ Richard F. Heck. "Aldehydes from Allylic Alcohols and Phenylpalladium Acetate: 2-Methyl-3-Phenylpropionaldehyde". Org. Synth.; Coll. Vol. 6: 815.
- ↑ Suggs, J W. "Palladium: Organometallic Chemistry." Encyclopedia of Inorganic Chemistry. Ed. R B. King. 8 vols. Chichester: Wiley, 1994.
- ↑
- ↑ Nikitin, Kirill V.; Andryukhova, N.P.; Bumagin, N.A.; Beletskaya, I.P. (1991). «Synthesis of Aryl Esters by Pd-catalysed Carbonylation of Aryl Iodides». Mendeleev Communications 1 (4): 129-131. doi:10.1070/MC1991v001n04ABEH000080.
- ↑
- ↑ Linli He, Shawn P. Allwein, Benjamin J. Dugan, Kyle W. Knouse, Gregory R. Ott, Craig A. Zificsak (2016). «Synthesis of α-Carboline». Org. Synth. 93: 272. doi:10.15227/orgsyn.093.0272.
- ↑ «Buchwald-Hartwig Cross Coupling Reaction». Organic Chemistry Portal.

