Aspectos biológicos del flúor

El flúor es un gas venenoso en su forma elemental en condiciones biológicas. Tiene una amplia gama de aplicaciones biológicas en la ecología, la ciencia médica y la ingeniería bioquímica.
Es uno de los elementos más reactivos y se encuentra presente en compuestos industriales potentes y bastante peligrosos para los organismos vivos, como el fluoruro de hidrógeno. Debido a que los enlaces carbono-flúor son difíciles de formar, no son comunes en la naturaleza, aunque algunas especies de plantas y bacterias son capaces de sintetizar venenos con flúor como método de defensa.
La fluoración es una poderosa técnica para el diseño de nuevos fármacos por permitir el ajuste de moléculas orgánicas de maneras innovadoras; Lipitor y Prozac son ejemplos de medicamentos basados en compuestos orgánicos de flúor. El ion fluoruro se une químicamente al esmalte de los dientes cuando se aplica tópicamente en productos dentales, y aumenta su resistencia a los ácidos. Aunque en algunos países este uso del flúor es políticamente controvertido, la fluoración de los suministros públicos de agua ha demostrado beneficios consistentes para la higiene dental, especialmente para los niños pobres. Los compuestos fluorados artificiales han dado lugar a preocupaciones ambientales notables. Los clorofluorocarbonos, otrora componentes importantes de numerosos productos comerciales y aerosoles, resultaron ser dañinos para la capa de ozono de la Tierra y su uso se restringió por el Protocolo de Montreal. La estabilidad de muchos compuestos fluorados orgánicos ha planteado la cuestión de la biopersistencia y efectos a largo plazo. Por ejemplo, ciertas moléculas, como por ejemplo los PFOA y PFOS, se encuentran en todo el mundo en los tejidos de la vida silvestre y los seres humanos, incluidos los recién nacidos.
La biología del flúor también es relevante para una serie de tecnologías de vanguardia. Los PFC (perfluorocarbonos) son capaces de contener suficiente oxígeno para permitir la respiración líquida humana. Varias obras de ciencia ficción han tocado esta aplicación, pero en el mundo real, los investigadores han experimentado con PFCs para el cuidado de pulmones dañados y como sustitutos de la sangre. El flúor, en forma de su radioisótopo F-18, es parte esencial de la técnica de imagen médica conocida como tomografía por emisión de positrones o PET, que produce imágenes en color tridimensionales de tejidos del cuerpo que consumen mucho azúcar, particularmente el cerebro o los tumores.
Bioquímica natural
[editar]
Se han encontrado algunos compuestos organofluorados sintetizados naturalmente en microorganismos y plantas,[1] pero no en animales.[2] El ejemplo más común es el fluoroacetato, con una molécula venenosa activa idéntica al fluoroacetato de sodio producido industrialmente.[3] Existen unas cuanrenta plantas verdes en Australia, Brasil y África que sintetizan este compuesto como defensa contra los herbívoros. Otros organofluorados de síntesis biológica son los ω-fluoro ácidos grasoss, la fluoroacetona, y el 2-fluorocitrato, posiblemente biosintetizados en las vías bioquímicas del intermedio fluoroacetaldehido.[2]
En las bacterias, se ha aislado la enzima adenosil-fluoruro sintasa, capaz de catalizar la formación del enlace carbono-flúor. Esta enzima se considera relevante para las rutas metabólicas para la biosíntesis de compuestos organofluorados.[4]
El flúor no se considera un elemento mineral esencial para los mamíferos y los seres humanos,[5] pero en pequeñas cantidades, puede ser beneficioso para la resistencia ósea.[6]
Cuidado dental
[editar]Desde mediados del siglo XX, se ha podido discernir a partir de estudios poblacionales que el fluoruro reduce la caries dental. Inicialmente, los investigadores plantearon la hipótesis de que el flúor ayuda a convertir la hidroxiapatita, presente en el esmalte dental, en fluorapatita, mineral menos soluble en ácido. Sin embargo, estudios más recientes no han mostrado diferencias en la frecuencia de caries entre dientes prefluorados en diferentes grados. La teoría más aceptada actualmente es que el flúor previene las caries en las primeras etapas de su formación.[7]

Cuando los dientes comienzan a decaer por el ácido producido por las bacterias a partir del azúcar presente en la boca, pierden calcio (desmineralización). Si la caries no está demasiado avanzada, el flúor parece reducir la desmineralización y aumentar la remineralización. Además, hay evidencia de que el fluoruro interfiere con las bacterias productoras de ácido.[7] Para tener efecto, el flúor debe aplicarse mediante un tratamiento tópico. Los iones fluoruro ingeridos no aportan beneficios.[7]
La fluoración del agua es la adición controlada de flúor a un suministro público de agua para reducir las caries dentales.[8] Su uso se inició en la década de 1940, después de los estudios realizados a niños de una región donde el agua tiene una concentración alta de flúor. En los años 90 se añadía flúor en los sistemas de agua públicos de cerca de dos tercios de la población de los Estados Unidos;[9] y para el 5.7 % en el resto del mundo.[10] Aunque la mejor evidencia disponible no muestra asociación con efectos adversos graves distintos a la fluorosis,[11] la fluoración del agua ha sido contenciosa por razones éticas, de seguridad y de eficacia. La oposición a la fluoruración del agua existe a pesar de su apoyo por las organizaciones de salud pública.[10] Los beneficios han disminuido recientemente, presuntamente por la disponibilidad de flúor en otras formas, pero aún son medibles, en particular para los grupos de bajos ingresos.[12] Una revisión sistemática en 2000 y 2007, mostró una reducción significativa de las caries en los niños asociada con la fluoración del agua.[13][14]
El fluoruro de sodio, difluoruro de estaño, y, más comúnmente, el monofluorofosfato de sodio se utilizan en la pasta de dientes. En 1955, la primera pasta de dientes con fluoruro fue introducida en los Estados Unidos. Ahora, casi todos los dentífricos en los países desarrollados están fluorados. Por ejemplo, el 95 % de las pastas de dientes en Europea contienen fluoruro.[13] Los geles y las espumas se recomiendan a menudo para los grupos especiales de pacientes, particularmente aquellos que experimentan radioterapia en la cabeza, como los pacientes de cáncer. El paciente recibe una aplicación de cuatro minutos de una gran cantidad de fluoruro. Los barnices, que pueden ser aplicados más rápidamente, existen y realizan una función similar. El flúor también es un componente de los enjuagues bucales y además, se usó como un indicador de los alimentos fabricados utilizando fuentes de agua fluorada.[15]
Aplicaciones médicas
[editar]Farmacia
[editar]
El veinte por ciento de los medicamentos comercializados, contienen flúor, incluidos fármacos importantes en muchas clases farmacéuticas diferentes.[16] Debido a la considerable estabilidad del enlace carbono-flúor, muchos fármacos están fluorados para retrasar su metabolismo y posterior eliminación. Esto prolonga su vida media y permite tiempos más largos entre la dosificación y la activación. Por ejemplo, un anillo aromático puede prevenir el metabolismo de un fármaco, pero presenta un problema de seguridad porque algunos compuestos aromáticos forman epóxidos venenosos al metabolizarse por las enzimas del organismo. Sin embargo, la sustitución de un flúor en una posición del anillo aromático lo protege e impide que se produzca el epóxido. La probabilidad de que el flúor se disgregue depende de su posición en la molécula,[17] pero es generalmente baja.
La adición de flúor a compuestos orgánicos biológicamente activos aumenta su lipofilia —capacidad de disolución en grasas— porque el enlace carbono-flúor es aún más hidrófobo que el enlace carbono-hidrógeno. Este efecto a menudo aumenta la biodisponibilidad de un fármaco debido al aumento de la penetración de la membrana celular.[18]
Los fluoros también encuentran su uso en los mineralocorticoides comunes, una clase de fármacos que aumentan la presión arterial. La adición de un flúor aumenta tanto su potencia médica como los efectos antiinflamatorios.[19] La fludrocortisona, que contiene flúor, es uno de los más comunes de estos fármacos.[20] La dexametasona y la triamcinolona, potentes fármacos sintéticos relacionados con los corticosteroides, también contienen flúor.[20]
Varios agentes anestésicos generales inhalados también contienen flúor. El primer agente anestésico fluorado, el halotano, resultó ser mucho más seguro, por no ser explosivo ni inflamable, y más duradero que los utilizados anteriormente. Los anestésicos fluorados modernos son más duraderos y casi insolubles en la sangre, lo que acelera la reanimación tras la anestesia.[21] Los ejemplos incluyen sevoflurano, desflurano, enflurano e isoflurano, todos derivados de hidrofluorocarbonos.[22]
Antes de los años ochenta, los antidepresivos no solo alteraban la captación de serotonina —cuya falta se asocia a la depresión—, sino también la absorción de norepinefrina, lo que causaba la mayoría de los efectos secundarios de los antidepresivos. El primer fármaco en afectar solo la captación de serotonina fue un compuesto orgánico fluorado, la fluoxetina, comercializada como Prozac y a fecha de 2004, era el antidepresivo más vendido. Muchos otros antidepresivos del mismo tipo contienen flúor, como Celexa, Luvox y Lexapro.[23]
Las fluoroquinolonas son una familia comúnmente utilizada de antibióticos de amplio espectro.[24]
|

|

|

|

|
|---|---|---|---|---|
| Lipitor (atorvastatina) | 5-FU (fluorouracilo) | Florinef (fludrocortisona) | Isoflurano | Risperdal (risperidona) |
Exploración
[editar]
Los compuestos de flúor-18, un isótopo radiactivo que emite positrones, se utilizan a menudo en la tomografía por emisión de positrones (PET) debido a que la vida media del isótopo de aproximadamente 110 minutos es lo suficientemente larga para esta aplicación. Uno de estos productos radiofarmacéuticos es la 2-desoxi-2-(18F)-fluoro-D-glucosa, denominada genéricamente fludesoxiglucosa, 18F-FDG, o simplemente FDG.[25] En las imágenes de PET, la FDG puede utilizarse para evaluar el metabolismo de la glucosa en el cerebro y para la obtención de imágenes de tumores. Después de su inyección en la sangre, la FDG es rápidamente absorbida por tejidos con una alta necesidad de glucosa, como el cerebro y la mayoría de los tumores malignos.[26] La tomografía puede usarse para diagnosticar o monitorizar el tratamiento de cánceres, especialmente el linfoma de Hodgkin, el cáncer de pulmón y el cáncer de mama.[27]
El flúor natural es monoisotópico y consiste únicamente de flúor-19. Los compuestos de flúor son altamente susceptibles a la resonancia magnética nuclear (RMN) debido a que el flúor-19 tiene un espín nuclear de 1/2, un momento magnético nuclear elevado y una alta relación magnetogírica. Los compuestos de flúor típicamente presentan una relajación rápida de la RMN, lo que permite el uso de una rápida ponderación para obtener una relación señal-ruido similar a los espectros de RMN de hidrógeno-1.[28] Fluorina-19 es de uso común en los estudios por RNM del metabolismo, la estructura y cambios conformacionales de las proteínas.[29] Además, los gases fluorados inertes tienen el potencial de ser una herramienta barata y eficiente para observar la ventilación pulmonar.[30]
Investigación del transporte de oxígeno
[editar]Los fluorocarbonos líquidos tienen una capacidad muy alta para mantener gases en solución. Pueden contener más oxígeno o dióxido de carbono que la sangre. Por esa razón, son de interés para campos de investigación como el desarrollo de sangre artificial o la respiración líquida.[31]

Los sustitutos de la sangre son objeto de investigación porque la demanda de transfusiones de sangre crece más rápido que las donaciones. En algunos casos, la sangre artificial puede ser más conveniente o segura. Debido a que los fluorocarbonos no suelen ser solubles en agua, deben mezclarse en emulsiones formadas por pequeñas gotas de perfluorocarbono suspendidas en agua para ser usadas como sangre.[32][33] Uno de estos productos, Oxycyte, se ha examinado en ensayos clínicos.[34][35]
Los posibles usos médicos de la respiración líquida con líquido perfluorocarbonado puro son asistencia para bebés prematuros o para víctimas de quemaduras en las que la función pulmonar normal está comprometida. Se ha experimentado con el llenado parcial y total de los pulmones, aunque sólo el primero se ha ensayado en seres humanos.[36] La compañía Alliance Pharmaceuticals inició ensayos clínicos, abandonados por no presentar ventajas suficientes en comparación con otras terapias.[37] Los nanocristales representan un posible método de administrar fármacos solubles en agua o grasa dentro de perfluoro líquido. El uso de estas partículas se está desarrollando para ayudar a tratar a los bebés con pulmones dañados.[38]
Los perfluorocarbonos están prohibidos en los deportes, donde pueden usarse por los atletas de resistencia para aumentar el uso de oxígeno. Un ciclista, Mauro Gianetti, fue investigado después de un accidente grave, donde se sospechaba el uso de PFC.[39][40]
Otros usos potenciales incluyen el buceo en aguas profundas y los viajes espaciales, aplicaciones que requieren una ventilación total, no parcial, con el líquido.[41][42] La película de 1989, The Abyss, muestra un uso ficticio de perfluorocarbono en el buceo, pero contiene una escena real de una rata que sobrevive una inmersión en perfluorocarbono.[43]
Productos agroquímicos
[editar]
El fluoroacetato de sodio sintético se utiliza como insecticida, pero es especialmente eficaz contra las plagas de mamíferos.[44] El nombre «1080» se refiere al número de catálogo del veneno, que se convirtió en su marca.[3] El fluoroacetato es similar al acetato, que tiene un papel fundamental en el ciclo de Krebs, parte fundamental del metabolismo celular. El fluoroacetato detiene el ciclo y lo que priva a las células de energía.[3] Otros insecticidas contienen fluoruro de sodio, que es mucho menos tóxico que el fluoroacetato.[45]
Se estima que el 30 % de los compuestos agroquímicos contienen flúor.[46] La mayoría de ellos se utilizan como venenos. La importancia de las aplicaciones agroquímicas del flúor dependen de dos factores: la reducción de precios que puedan alcanzar los productos donde se usa; y las consideraciones ecológicas —los compuestos químicos fluorados son más respetuosos con el medio ambiente que otras opciones-.[47]
La trifluralina fue ampliamente utilizada en el siglo XX. Por ejemplo, en 1998 se usaba en más de la mitad de la superficie cultivada de algodón de los Estados Unidos.[48] Algunos países del norte de Europa lo prohibieron en 1993, por existir sospechas de que tiene propiedades carcerígenas.[49] Más tarde la Unión Europea lo prohibió, aunque Dow Agrosciences hizo un caso para cancelar la decisión en 2011.[50]
Los productos agroquímicos utilizados actualmente utilizan otra táctica: en lugar de tener efectos tóxicos directos, transforman el metabolismo para que el organismo produzca compuestos venenosos. Por ejemplo, los insectos alimentados con 29-fluorostigmasterol producen fluoroacetatos.[51]
Riesgos
[editar]

Flúor gaseoso
[editar]El flúor elemental es altamente tóxico. Por encima de una concentración de 25 ppm, causa irritación significativa en los ojos, las vías respiratorias, los pulmones, y puede afectar al hígado y a los riñones. Con una concentración de 100 ppm, daña seriamente los ojos y la nariz humanos.[53] Las personas pueden estar expuestas al flúor en el lugar de trabajo al respirar, por contacto con la piel o con los ojos. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal o límite de exposición permisible para el flúor en el lugar de trabajo como 0,1 ppm (0,2 mg/m³) durante una jornada laboral de 8 horas. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,1 ppm (0,2 mg/m³) durante una jornada laboral de 8 horas. A niveles de 25 ppm, el flúor es inmediatamente peligroso para la vida y la salud.[54]
Ácido fluorhídrico
[editar]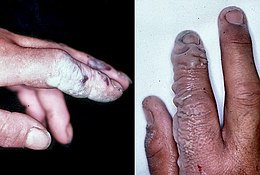
El ácido fluorhídrico, la solución acuosa de fluoruro de hidrógeno, es tóxico por contacto. Aunque químicamente es un ácido débil, es más peligroso que los ácidos minerales fuertes, como el ácido nítrico, el ácido sulfúrico o el ácido clorhídrico: debido a su menor disociación química en el agua, penetra en los tejidos más rápidamente que estos. El envenenamiento puede ocurrir fácilmente a través de la piel o los ojos o cuando se inhala o traga.
Una vez en la sangre, el fluoruro de hidrógeno reacciona con el calcio y el magnesio, dando como resultado un desequilibrio electrolítico y, potencialmente, hipocalcemia. La consiguiente arritmia cardíaca puede ser mortal.[56] La formación de fluoruro de calcio insoluble también causa un dolor fuerte.[57] Las quemaduras de áreas mayores de 160 cm², aproximadamente del tamaño de la mano de un hombre, pueden causar toxicidad sistémica grave.[58] De 1984 a 1994, al menos nueve trabajadores estadounidenses murieron por accidentes con este compuesto.[56]
Los síntomas de la exposición al ácido fluorhídrico pueden no ser inmediatamente evidentes, con un retraso de 8 horas para concentraciones del 50 % y hasta 24 horas para concentraciones más bajas. El fluoruro de hidrógeno interfiere con la función nerviosa, lo que significa que las quemaduras pueden no ser dolorosas inicialmente.
Al producirse la quemadura esta debe lavarse con una corriente de agua fuerte de diez a quince minutos para evitar la penetración del ácido en el cuerpo. La ropa en contacto con el compuesto también puede presentar un peligro.[59] La zona expuesta al ácido fluorhídrico se trata a menudo con un gel de gluconato de calcio al 2,5 %, una fuente de calcio que se combina con los iones fluoruro,[60][61] o soluciones especiales de enjuague.[62] La absorción del ácido requiere un tratamiento médico adicional. El gluconato de calcio se puede inyectar o administrar por vía intravenosa. El uso de cloruro de calcio, sin embargo, está contraindicado y puede conducir a complicaciones graves. A veces se requiere la extirpación quirúrgica del tejido o la amputación.[58][63]
Ion fluoruro
[editar]
Los fluoruros solubles son moderadamente tóxicos. Para el fluoruro sódico, la dosis letal para adultos es de 5-10 g, lo que equivale a 32-64 mg de fluoruro elemental por kilogramo de peso corporal.[64] La dosis que puede conducir a efectos adversos para la salud es aproximadamente un quinto de la dosis letal.[65] El consumo crónico de un exceso de flúor puede conducir a la fluorosis esquelética, una enfermedad de los huesos que afecta a millones en Asia y África.[65][66]
El ion fluoruro es fácilmente absorbido por el estómago y los intestinos. El fluoruro ingerido forma ácido fluorhídrico en el estómago. De esta forma, el fluoruro atraviesa las membranas celulares y luego se une con el calcio e interfiere con diversas enzimas. El flúor se excreta a través de la orina. Los límites de exposición al flúor se basan en la prueba de orina, que se utiliza para determinar la capacidad del cuerpo humano para librarse del fluoruro.[65][67]
Históricamente, la mayoría de los casos de envenenamiento por fluoruro han sido causados por la ingestión accidental de insecticidas que contienen fluoruro inorgánico.[68] La mayoría de las llamadas a los centros de control de envenenamiento por sospecha de intoxicación por fluoruro tienen como origen la ingestión de pasta de dientes.[65] El mal funcionamiento del equipo de fluoración del agua puede ser causa de intoxicaciones, como ocurrió en un incidente en Alaska donde enfermaron casi trescientas personas y murió una.[69]
Biopersistencia
[editar]Debido a la fuerza del enlace carbono-flúor, los organofluoruros no se descomponen en el medio ambiente. Los compuestos perfluorados (PFC) han atraído una atención especial como contaminantes globales persistentes. Estos compuestos pueden entrar en el medio ambiente durante su uso directo en tratamientos de impermeabilización y como espuma contra incendios, o indirectamente por fugas en plantas de producción de fluoropolímeros. Debido al grupo ácido, los PFC son solubles en agua en bajas concentraciones.[70] La mayor parte de la investigación ambiental se ha llevado a cabo sobre el ácido perfluorooctanosulfónico (PFOS) y ácido perfluorooctanoico (PFOA). La Agencia de Protección Ambiental de los Estados Unidos clasifica estos materiales como «contaminantes emergentes» basados en el creciente, pero aún incompleto, entendimiento de su impacto ambiental.[71][72][73]
Se han detectado PFC en todo el mundo y en todo tipo de organismos. Tanto el PFOS y el PFOA se han detectado en la leche materna y la sangre de los recién nacidos. Una publicación de 2013 mostró cantidades muy variadas de PFOS y PFOA en diferentes suelos y aguas subterráneas, sin patrón claro de dominancia de un solo producto. Las concentraciones de PFC fueron generalmente más altas en áreas con mayor población humana o actividad industrial, y las áreas con más PFOS generalmente también tenían también más PFOA.[74] Los dos productos químicos se han encontrado en diferentes concentraciones en diferentes poblaciones; por ejemplo, un estudio halló más PFOS que PFOA en los alemanes, mientras que otro, mostró lo contrario para los estadounidenses. Los PFC pueden estar comenzando a disminuir en la biosfera: un estudio indicó que los niveles de PFOS en la vida silvestre en Minnesota estaban disminuyendo, presumiblemente porque 3M interrumpió su producción.[71][72]

En el cuerpo, los PFC se unen a proteínas como la albúmina sérica. Su distribución de tejido en humanos es desconocida, pero varios estudios en ratas sugieren que está presente principalmente en el hígado, el riñón y la sangre. No se metabolizan pero se eliminan por los riñones. El tiempo de permanencia en el cuerpo varía mucho según las especies. En los roedores tienen una vida media de días, mientras que en los seres humanos pueden permanecen años. Muchos animales muestran diferencias sexuales en la capacidad de excretar PFOA, pero sin un patrón claro. Las diferencias por género de la vida media varían según las especies animales.[71][72][75]
El impacto potencial en la salud de los PFC no está claro. A diferencia de los hidrocarburos clorados, los PFC no son lipofílicos ni genotóxicos. En dosis altas, tanto los PFOA como los PFOS causan cáncer y la muerte de recién nacidos en roedores. Los estudios en seres humanos no han podido probar un impacto a exposiciones usuales. Los delfines nariz de botella presentan una de las concentraciones más altas de PFOS de cualquier fauna estudiada; un estudio sugiere un impacto en su sistema inmune.[71][72][75] Las causas bioquímicas de la toxicidad tampoco son claras y pueden diferir según la molécula, la salud, e incluso el animal. PPAR-alfa es una proteína que interactúa con PFOA y está comúnmente implicada en el cáncer de roedores.[71][72][75]
También se pueden detectar productos químicos fluorados (es decir, compuestos no perfluorados) en el medio ambiente. Dado que los sistemas biológicos no metabolizan las moléculas fluoradas fácilmente, los productos farmacéuticos fluorados como los antibióticos y los antidepresivos se pueden encontrar en las aguas residuales tratadas o no tratadas.[76] Los productos agroquímicos que contienen flúor son medibles en la escorrentía de las tierras de cultivo y en los ríos cercanos.[77]
Referencias
[editar]- ↑ Gribble, Gordon W. (2002). «Naturally occurring organofluorines». The Handbook of Environmental Chemistry. The Handbook of Environmental Chemistry. 3N: 121-136. ISBN 3-540-42064-9. doi:10.1007/10721878_5.
- ↑ a b Murphy, C.; Schaffrath, C.; O'Hagan, D. (2003). «Fluorinated natural products: The biosynthesis of fluoroacetate and 4-fluorothreonine in Streptomyces cattleya». Chemosphere 52 (2): 455-461. PMID 12738270. doi:10.1016/S0045-6535(03)00191-7.
- ↑ a b c Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. (2006). «Sodium fluoroacetate poisoning». Toxicological Reviews 25 (4): 213-219. PMID 17288493. doi:10.2165/00139709-200625040-00002.
- ↑ O'Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T.; Murphy, C. D. (2002). «Biochemistry: Biosynthesis of an organofluorine molecule». Nature 416 (6878): 279. Bibcode:2002Natur.416..279O. PMID 11907567. doi:10.1038/416279a.
- ↑ Olivares, M.; Uauy, R. (2004). «Essential nutrients in drinking water (Draft)». WHO. Archivado desde el original el 19 de octubre de 2012. Consultado el 30 de diciembre de 2008.
- ↑ Nielsen, Forrest H. (2009). «Micronutrients in parenteral nutrition: Boron, silicon, and fluoride». Gastroenterology 137 (5 Suppl): S55-S60. PMID 19874950. doi:10.1053/j.gastro.2009.07.072.
- ↑ a b c Pizzo G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (2007). «Community water fluoridation and caries prevention: a critical review». Clinical Oral Investigation 11 (3): 189-193. PMID 17333303. doi:10.1007/s00784-007-0111-6.
- ↑ Centers for Disease Control and Prevention (2001). «Recommendations for using fluoride to prevent and control dental caries in the United States». MMWR Recommendations and Reports 50 (RR–14): 1-42. PMID 11521913.
- ↑ Ripa, L. W. (1993). «A half-century of community water fluoridation in the United States: review and commentary». Journal of Public Health Dentistry 53 (1): 17-44. PMID 8474047. doi:10.1111/j.1752-7325.1993.tb02666.x. Archivado desde el original el 4 de marzo de 2009.
- ↑ a b Cheng, K. K.; Chalmers, I.; Sheldon, T. A. (2007). «Adding fluoride to water supplies». BMJ 335 (7622): 699-702. PMC 2001050. PMID 17916854. doi:10.1136/bmj.39318.562951.BE. Archivado desde el original el 3 de marzo de 2016. Consultado el 14 de noviembre de 2016.
- ↑ Marya, C. M. (2011). A textbook of public health dentistry. JP Medical Limited. p. 343. ISBN 9789350252161.
- ↑ Armfield, J. M. (2007). «When public action undermines public health: A critical examination of antifluoridationist literature». Australia and New Zealand Health Policy 4 (1): 25. PMC 2222595. PMID 18067684. doi:10.1186/1743-8462-4-25.
- ↑ a b Fejerskov, Ole; Kidd, Edwina (2008). Dental caries: The disease and its clinical management. John Wiley & Sons. p. 518. ISBN 978-1-4051-3889-5.
- ↑ National Health and Medical Research Council (Australia) (2007). «A systematic review of the efficacy and safety of fluoridation». Archivado desde el original el 13 de enero de 2012. Consultado el 24 de febrero de 2009. Summary: Yeung, C. A. (2008). «A systematic review of the efficacy and safety of fluoridation». Evidence-Based Dentistry 9 (2): 39-43. PMID 18584000. doi:10.1038/sj.ebd.6400578.
- ↑ Cracher, Connie Myers (2009). «Current concepts in preventive dentistry». dentalcare.com. p. 12. Archivado desde el original el 14 de octubre de 2013. Consultado el 20 de enero de 2012.
- ↑ Emsley, John (2011). Nature's building blocks: An A–Z guide to the elements (2nd edición). Oxford University Press. p. 178. ISBN 978-0-19-960563-7.
- ↑ Schubiger, P. A. (2006). Pet chemistry: The driving force in molecular imaging. Springer. p. 144. ISBN 9783540326236.
- ↑ Swinson, Joel (2005). «Fluorine – A vital element in the medicine chest». PharmaChem (Pharmaceutical Chemistry): 26-27. Archivado desde el original el 8 de febrero de 2012. Consultado el 26 de agosto de 2010.
- ↑ Goulding, Nicolas J.; Flower, Rod J. (2001). Glucocorticoids. Springer. p. 40. ISBN 9783764360597.
- ↑ a b Raj, P. Prithvi; Erdine, Serdar (2012). Pain-relieving procedures: The illustrated guide. John Wiley & Sons. p. 58. ISBN 9781118300459.
- ↑ Bégué, Jean-Pierre; Bonnet-Delpon, Daniele (2008). Bioorganic and Medicinal Chemistry of Fluorine. John Wiley & Sons. pp. 335–336. ISBN 9780470281871.
- ↑ Filler, R.; Saha, R. (2009). «Fluorine in medicinal chemistry: A century of progress and a 60-year retrospective of selected highlights». Future Medicinal Chemistry 1 (5): 777-791. PMID 21426080. doi:10.4155/fmc.09.65. Archivado desde el original el 22 de octubre de 2013.
- ↑ Mitchell, E. Siobhan; Triggle, D. J. (2004). Antidepressants. Infobase Publishing. pp. 37-39. ISBN 978-1-4381-0192-7.
- ↑ Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (2007). «Fluoroquinolone-resistant Campylobacter species and the withdrawal of fluoroquinolones from use in poultry: a public health success story». Clinical Infectious Diseases 44 (7): 977-980. PMID 17342653. doi:10.1086/512369.
- ↑ Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). «Use of fluorine-18 fluoro-2-deoxy-D-glucose positron emission tomography in assessing the process of tuberculous spondylitis». Journal of spinal disorders 13 (6): 541-544. PMID 11132989. doi:10.1097/00002517-200012000-00016.
- ↑ Bustamante, Ernesto; Pedersen, Peter L. (1977). «High aerobic glycolysis of rat hepatoma cells in culture: Role of mitochondrial hexokinase». Proceedings of the National Academy of Sciences of the United States of America 74 (9): 3735-3739. Bibcode:1977PNAS...74.3735B. PMC 431708. PMID 198801. doi:10.1073/pnas.74.9.3735.
- ↑ Hayat, M. A. (2007). Cancer imaging: Lung and breast carcinomas. Academic Press. p. 41. ISBN 9780123742124.
- ↑ Nelson, J. H. (2003). Nuclear magnetic resonance spectroscopy. Prentice Hall. pp. 129-139. ISBN 0-13-033451-0.
- ↑ Danielson, Mark A.; Falke, Joseph J. (1996). «Use of 19F NMR to probe protein structure and conformational changes». Annual Review of Biophysics and Biomolecular Structure 25: 163-195. PMC 2899692. PMID 8800468. doi:10.1146/annurev.bb.25.060196.001115.
- ↑ Kuethe, Dean O.; Caprihan, Arvind; Fukushima, Eiichi; Waggoner, R. Allen (2005). «Imaging lungs using inert fluorinated gases». Magnetic Resonance in Medicine 39 (1): 85-88. PMID 9438441. doi:10.1002/mrm.1910390114.
- ↑ Gabriel, J. L.; Miller, T. F.; Wolfson, M. R. Jr; Shaffer, T. H. (1996). «Quantitative structure-activity relationships of perfluorinated hetro-hydrocarbons as potential respiratory media. Application to oxygen solubility, partition coefficient, viscosity, vapor pressure, and density». ASAIO Journal 42 (6): 968-973. PMID 8959271. doi:10.1097/00002480-199642060-00009.
- ↑ Sarkar, S. (2008). «Artificial Blood». Indian Journal of Critical Care Medicine 12 (3): 140-144. PMC 2738310. PMID 19742251. doi:10.4103/0972-5229.43685.
- ↑ Schimmeyer, S. (2002). «The search for a blood substitute». Illumin (University of Southern Carolina) 5 (1). Archivado desde el original el 2 de octubre de 2011. Consultado el 2 de diciembre de 2010.
- ↑ Tasker, Fred (19 de marzo de 2008). Miami Herald: Artificial blood goes from science fiction to science fact. Miami Herald (at noblood.org). Archivado desde el original el 24 de julio de 2008. Consultado el 14 de noviembre de 2016.
- ↑ Davis, Nicole (2006). «Better than blood». Popular Science. Archivado desde el original el 4 de junio de 2011. Consultado el 30 de septiembre de 2012.
- ↑ Shaffer, T. H.; Wolfson, M. R.; Clark, L. R. (1992). «State of art review: Liquid ventilation». Pediatric Pulmonology 14 (102–109): 102-9. PMID 1437347. doi:10.1002/ppul.1950140208.
- ↑ Kacmarek, R. M.; Wiedemann, H. P.; Lavin, P. T.; Wedel, M. K.; Tütüncü, A. S.; Slutsky, A. S. (2006). «Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome». American Journal of Respiratory and Critical Care Medicine 173 (8): 882-889. PMID 16254269. doi:10.1164/rccm.200508-1196OC.
- ↑ Shaffer, Thomas H.; Wolfson, Marla R.; Greenspan, Jay S. (1999). «Liquid ventilation: Current status». Pediatrics in Review 20 (12): e134-e142. PMID 10587539. doi:10.1542/pir.20-12-e134.
- ↑ Gains, Paul (18 de octubre de 1998). «A New Threat in Blood Doping». New York Times.
- ↑ http://www.salon.com/1999/04/21/cycling/
- ↑ Kylstra, J. A. (1977). The feasibility of liquid breathing in man. Duke University. Archivado desde el original el 7 de julio de 2008. Consultado el 5 de mayo de 2008.
- ↑ The Global Oneness Commitment. «Liquid breathing – Space travel». experiencefestival.com. Archivado desde el original el 17 de abril de 2010. Consultado el 17 de mayo de 2008.
- ↑ Aljean Harmetz (1989). «FILM; 'The Abyss': A foray into deep waters». The New York Times. Consultado el 2 de octubre de 2012.
- ↑ Eisler, Ronald (1995), Biological report 27: Sodium monofluoroacetate (1080) Hazards to fish, wildlife and invertebrates: A synoptic review (en inglés), Patuxent Environmental Science Center (U.S. National Biological Service), archivado desde el original el 12 de junio de 2010, consultado el 5 de junio de 2011.
- ↑ «Class I ozone-depleting substances». Sodium fluoride – pesticidal uses. Scorecard. Archivado desde el original el 11 de julio de 2011. Consultado el 20 de febrero de 2011.
- ↑ «Fluorine's treasure trove». ICIS news. 2 de octubre de 2006. Consultado el 20 de febrero de 2011.
- ↑ Theodoridis, George (2006). Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Elseiver. pp. 121-176. ISBN 9780444526724.
- ↑ «Fact sheet: Trifluralin». Pesticides News 52: 20-21. 2001.
- ↑ European Commission (2007), Trifluralin.
- ↑ Case T-475/07, Dow AgroSciences Ltd vs. European Commission (2011). The General Court of European Union (Third Camber).
- ↑ Barnette, William E. (1995). «Physical Organic Aspects of Fluorinated Argichemicals». Fluorine in agriculture. Smithers Rapra Publishing. pp. 1-19. ISBN 9781859570333.
- ↑ NOAA 9F data sheet.
- ↑ Keplinger y Suissa, 1968.
- ↑ «CDC - NIOSH Pocket Guide to Chemical Hazards - Fluorine». www.cdc.gov. Consultado el 3 de noviembre de 2015.
- ↑ Eaton, Charles. «Figure hfl». E-Hand.com: the electronic textbook of hand surgery. The Hand Center (former practice of Dr. Eaton). Consultado el 28 de septiembre de 2013.
- ↑ a b Blodgett, Suruda y Crouch, 2001.
- ↑ Hoffman et al., 2007, p. 1333.
- ↑ a b HSM, 2006.
- ↑ Fischman, 2001.
- ↑ el Saadi et al., 1989.
- ↑ Roblin et al., 2006.
- ↑ Hultén et al., 2004.
- ↑ Zorich, 1991, pp. 182-183.
- ↑ Liteplo, 2002, p. 100.
- ↑ a b c d Shin y Silverberg, 2013.
- ↑ Reddy, 2009.
- ↑ Baez, Baez y Marthaler, 2000.
- ↑ Augenstein et al., 1991.
- ↑ Gessner et al., 1994.
- ↑ John P. Giesy and Kurunthachalam Kannan Perfluorochemical Surfactants in the Environment, 1 Abril 2002, Environmental Science & Technology, 147-152.
- ↑ a b c d e Steenland K, Fletcher T, Savitz DA (2010). «Epidemiologic evidence on the health effects of perfluorooctanoic acid (PFOA)». Environ. Health Perspect. 118 (8): 1100-8. PMC 2920088. PMID 20423814. doi:10.1289/ehp.0901827.
- ↑ a b c d e Betts, Kellyn (2007). «PFOS and PFOA in Humans: New Study Links Prenatal Exposure to Lower Birth Weight». Environmental Health Perspectives (en inglés) 115 (11): a. ISSN 0091-6765. PMC 2072861. PMID 18007977. doi:10.1289/ehp.115-a550a.
- ↑ «Emerging Contaminants Fact Sheet- PFOS and PFOA». Archivado desde el original el 29 de octubre de 2013. Consultado el 1 de noviembre de 2013.
- ↑ P. Zareitalabad, J. Siemens, M. Hamer, W. Amelung Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients Archivado el 4 de marzo de 2016 en Wayback Machine. Chemosphere 91 (2013) 725–732. Review
- ↑ a b c Lau C, Anitole K, Hodes C, Lai D, Pfahles-Hutchens A, Seed J. Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings Toxicol Sci. 99(2), 366–394 (2007) doi:10.1093/toxsci/kfm128
- ↑ Lietz y Meyer, 2006, pp. 7–8.
- ↑ Ahrens, 2011.
Bibliografía
[editar]- Ahrens, Lutz (2011), Polyfluoroalkyl compounds in the aquatic environment: a review of their occurrence and fate (en inglés) 13 (1), pp. 20-31, ISSN 1464-0325, doi:10.1039/C0EM00373E.
- Augenstein, W. L.; Spoerke, D. G.; Kulig, K. W.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; el Saadi, M.; Rumack, B. H. (1991), Fluoride ingestion in children: a review of 87 cases (en inglés) 88 (5), pp. 907-912, ISSN 0031-4005, PMID 1945630.
- Baez, R. J.; Baez, M. X.; Marthaler, T. M. (2000), Urinary fluoride excretion by children 4-6 years old in a south Texas community (en inglés) 7 (4), pp. 242-248, ISSN 1020-4989, PMID 10846927, doi:10.1590/s1020-49892000000400005.
- Blodgett, David W.; Suruda, Anthony J.; Crouch, Barbara Insley (2001), «Fatal unintentional occupational poisonings by hydrofluoric acid in the U.S.», American Journal of Industrial Medicine (en inglés) 40 (2): 215-220, ISSN 1097-0274, doi:10.1002/ajim.1090.
- Fischman, Michael L.; Krieger, Gary R. (2001), «Clinical Dermatotoxicology», en John Burke Sullivan, Gary R. Krieger, ed., Clinical environmental health and toxic exposures (en inglés) (2.ª edición), Lippincott Williams & Wilkins, ISBN 0-683-08027-X, OCLC 41606485.
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. (1994), Acute fluoride poisoning from a public water system (en inglés) 330 (2), pp. 95-99, ISSN 0028-4793, PMID 8259189, doi:10.1056/NEJM199401133300203.
- Hoffman et al. (2007), Goldfrank's Manual of Toxicologic Emergencies (en inglés), New York: McGraw-Hill Professional, ISBN 978-0-07-144310-4.
- Honeywell (2006), Recommended medical treatment for hydrofluoric acid exposure (en inglés), Morristown: Honeywell International, archivado desde el original el 8 de octubre de 2013, consultado el 9 de enero de 2014.
- Hultén, Peter; Höjer, J.; Ludwigs, U.; Janson, A. (2004), Hexafluorine vs. standard decontamination to reduce systemic toxicity after dermal exposure to hydrofluoric acid (en inglés) 42 (4), pp. 355-361, ISSN 0731-3810, PMID 15461243, doi:10.1081/clt-120039541.
- Lietz, Arthur C.; Meyer, Michael T. (2006), Evaluation of emerging contaminants of concern at the South District Wastewater Treatment Plant based on seasonal events, Miami-Dade County, Florida, 2004 (en inglés), US Geological Survey, doi:10.3133/sir20065240.
- Liteplo, R. (2002), Fluorides (en inglés), World Health Organization. United Nations Environment Programme. International Labour Organisation. Inter-Organization Programme for the Sound Management of Chemicals.International Program on Chemical Safety. WHO Task Group on Environmental Health Criteria for Fluorides., ISBN 92-4-157227-2, OCLC 50411238.
- Roblin, Isabelle; Urban, Martine; Flicoteau, Domitille; Martin, Chantel; Pradeau, Dominique (2006), Topical treatment of experimental hydrofluoric acid skin burns by 2.5% calcium gluconate (en inglés) 27 (6), pp. 889-894, ISSN 1559-047X, PMID 17091088, doi:10.1097/01.BCR.0000245767.54278.09.
- Reddy, D. Raja (2009), Neurology of endemic skeletal fluorosis (en inglés) 57 (1), pp. 7-12, ISSN 0028-3886, PMID 19305069, doi:10.4103/0028-3886.48793.
- el Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. I.; Rumack, B. H. (1989), Hydrofluoric acid dermal exposure (en inglés), PMID 2741315.
- Shin, Richard D.; Silverberg, Mark A. (2013), «Fluoride Toxicity: Background, Pathophysiology, Etiology», Medscape (en inglés).
- Keplinger, M. L.; Suissa, L. W. (1968), «Toxicity of Fluorine Short-Term Inhalation», American Industrial Hygiene Association Journal 29 (1): 10-18, ISSN 0002-8894, PMID 5667185, doi:10.1080/00028896809342975.
- Zorich, Robert (1991), Handbook of Quality Integrated Circuit Manufacturing (en inglés), Elsevier Science, ISBN 978-0-323-14055-3, OCLC 829460292.
