Boroxina
| Boroxina | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula estructural |
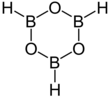 | |
| Fórmula molecular |
B 3H 3O 3 | |
| Identificadores | ||
| Número CAS | 289-56-5[1] | |
| ChEBI | 33120 | |
| ChemSpider | 119911 | |
| PubChem | 136134 | |
| Propiedades físicas | ||
| Masa molar | 84,036135156 g/mol | |
La boroxina (B3H3O3) es un compuesto heterocíclico de 6 miembros formado por una alternancia de átomos de oxígeno y de boro monohidrogenado. Los derivados de la boroxina (anhídridos borónicos), como la trimetilboroxina y la trifenilboroxina, también forman una clase más amplia de compuestos denominados boroxinas.[2] Estos compuestos son sólidos que suelen estar en equilibrio con sus respectivos ácidos borónicos a temperatura ambiente.[2][3][4] Además de utilizarse en estudios teóricos, la boroxina se utiliza principalmente en la producción de óptica.[5]
Estructura y enlace
[editar]Los compuestos de boro de tres coordenadas suelen presentar una geometría plana trigonal, por lo que el anillo de boroxina también está encerrado en una geometría plana.[6][3] Estos compuestos son isoelectrónicos al benceno. Con el orbital p vacante en los átomos de boro, pueden poseer cierto carácter aromático.[3][7] Los enlaces simples de boro en los compuestos de boroxina son en su mayoría de carácter s.[6] La boroxina etil-sustituida tiene longitudes de enlace B-O de 1,384 Å y B-C de 1,565 Å.[7] La boroxina sustituida por fenilo tiene longitudes de enlace similares de 1,386 Å y 1,546 Å respectivamente, lo que demuestra que el sustituyente tiene poco efecto en el tamaño del anillo de boroxina.[7]
Las sustituciones en un anillo de boroxina determinan su estructura cristalina. Las boroxinas sustituidas por alquilos tienen la estructura cristalina más sencilla. Estas moléculas se apilan unas sobre otras, alineando un átomo de oxígeno de una molécula con un átomo de boro de otra, dejando cada átomo de boro entre otros dos átomos de oxígeno. Así se forma un tubo a partir de los anillos individuales de boroxina. La distancia intermolecular B-O de la boroxina sustituida por etilo es de 3,462 Å, mucho mayor que la distancia de enlace B-O de 1,384 Å. La estructura cristalina de la boroxina sustituida por fenilo es más compleja. La interacción entre los orbitales p vacantes en los átomos de boro y los electrones π en los sustituyentes aromáticos fenilo provoca una estructura cristalina diferente. El anillo de boroxina de una molécula se apila entre dos anillos de fenilo de otras moléculas. Esta disposición permite que los sustituyentes fenilo donen densidad de electrones π a los orbitales p vacantes del boro.[7]
Síntesis
[editar]Como se descubrió en la década de 1930, las boroxinas se producen a partir de sus correspondientes ácidos borónicos por deshidratación.[2][3][4] Esta deshidratación puede realizarse mediante un agente desecante o por calentamiento a alto vacío.[3] Una síntesis más reciente de la trimetilboroxina implica la reacción de monóxido de carbono con borano (B2H6) y borohidruro de litio (LiBH4) como catalizador:[6]
Reacciones
[editar]La trimetilboroxina se utiliza en la metilación de diversos haluros de arilo mediante reacciones de acoplamiento de Suzuki-Miyaura catalizadas por paladio:[8]
Otra forma de la reacción de acoplamiento Suzuki-Miyaura muestra selectividad hacia los cloruros de arilo:[9]

Las boroxinas también se han examinado como precursores del oxoborano monomérico, HB≡O.[3] Este compuesto se convierte rápidamente de nuevo en la boroxina cíclica, incluso a bajas temperaturas.[4]
Referencias
[editar]- ↑ Número CAS
- ↑ a b c Brown, H.C. Boranes in Organoc Chemistry; Cornell University Press: Ithaca, 1972; pp. 346–347.
- ↑ a b c d e Hall, Dennis G. (2005). Boronic Acids – Preparation and Applications in Organic Synthesis and Medicine. John Wiley & Sons ISBN 3-527-30991-8.
- ↑ a b c Westcott, S.A. (2010). «BO Chemistry Comes Full Circle». Angewandte Chemie International Edition 49 (48): 9045-9046. PMID 20878818. doi:10.1002/anie.201003379.
- ↑ Wu, Q.G.; G. Wu; L. Leon Branca; S. Wang (1999). «B3O3Ph3 (7-Azaindole): Structure, Luminescence, and Fluxionality». Organometallics 18 (13): 2552-2556. doi:10.1021/om990053t.
- ↑ a b c Onak, T. in Organoborane Chemistry; Maitles, P.M., Stone, F.G.A., West, R., Eds.; Academic Press: New York, 1975; pp. 2,4,16,44.
- ↑ a b c d Haberecht, M.C.; Bolte, Michael; Wagner, Matthias; Lerner, Hans-Wolfram (2005). «A New Polymorph of Tri(p-tolyl)boroxine». Journal of Chemical Crystallography 35 (9): 657-665. doi:10.1007/s10870-005-3325-y.
- ↑ Gray, M.; Andrews, I.P.; Hook, D.F.; Kitteringham, J.; Voyle, M. (2000). «Practical Methylation of Aryl Halides by Suzuki-Miyaura Coupling». Tetrahedron 41 (32): 6237-6240. doi:10.1016/S0040-4039(00)01038-8.
- ↑ Song, C.; Ma, Y.; Chai, Q.; Ma, C.; Jaing, W.; Andrus, M.B. (2005). «Palladium Catalyzed Suzuki-Miyaura Coupling With Aryl Chlorides Using a Bulky Phenanthryl N-heterocyclic Carbene Ligand». Tetrahedron 61 (31): 7438-7446. doi:10.1016/j.tet.2005.05.071.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Boroxine» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.

![{\displaystyle {\ce {3CO}}+1.5\ \overbrace {{\ce {B2H6}}} ^{{\ce {borano}}}\ {\ce {->[{\ce {LiBH4}}] (CH3BO)3}}}](https://wikimedia.org/eswiki/api/rest_v1/media/math/render/svg/5c3beae543e94ad77779cb666d8d0fa20d4e8160)
![{\displaystyle {\ce {{\overset {(X = Br, I)}{C6H5X}}+ (CH3BO)3 ->[{\ce {K2CO3, Pd(PPh3)4}}][{\ce {dioxano}}] C6H5CH3}}}](https://wikimedia.org/eswiki/api/rest_v1/media/math/render/svg/dace4ed07f157d6b963059b83c7eb4c1da0b7455)