Bromuro de plata
| Bromuro de plata | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Bromuro de plata | ||
| General | ||
| Fórmula molecular | AgBr | |
| Identificadores | ||
| Número CAS | 7785-23-1[1] | |
| ChemSpider | 59584 | |
| PubChem | 66199 | |
| Propiedades físicas | ||
| Apariencia |
sólido amarillo pálido fotosensible | |
| Densidad | 6473 kg/m³; 6,473 g/cm³ | |
| Masa molar | 18 877 g/mol | |
| Punto de fusión | 432 °C (705 K) | |
| Punto de ebullición | 1502 °C (1775 K) | |
| Índice de refracción (nD) | 2,253 | |
| Banda prohibida | 2,5 eV | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,140 mg/L (20 °C) | |
| Solubilidad |
insoluble en alcohol, mayoría de ácidos poco soluble en amoniaco soluble en soluciones de cianuro alcalinas | |
| Producto de solubilidad | 5,4 × 10 −13 | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bromuro de plata es un compuesto químico, cuya fórmula es AgBr, ampliamente utilizado en el campo de la fotografía debido a su sensibilidad a la luz.[2]
Empleo
[editar]El bromuro de plata se utiliza en la emulsión del papel fotográfico. Las sales se depositan en suspensión en una capa de gelatina. Cuando la luz incide sobre el compuesto, la plata y el bromuro se ionizan, lo cual genera una imagen latente en las partes del negativo que contienen el bromuro de plata ionizado por la luz. Mediante el proceso de revelado, el agente revelador, que puede estar compuesto por metol (genol) e hidroquinona,[3] cede electrones al bromuro de plata ionizado, estabilizando los dos elementos del compuesto y por ende separándolos.
Obtención
[editar]Aunque también puede encontrarse en forma mineral, el bromuro de plata suele prepararse con la reacción de nitrato de plata (AgNO3) y bromuro de potasio (KBr).[4][5]
Propiedades
[editar]El bromuro de plata no es casi soluble en agua, pero más fácilmente en disoluciones de amoníaco o tiosulfato.
Reactividad química
[editar]El bromuro de plata reacciona fácilmente con amoníaco líquido para generar una variedad de aminocomplejos:[6]
AgBr + nNH3 → Ag(NH3)21+
- {AgBr(NH3)2}
{AgBr2(NH3)2}1−
{AgBr(NH3)}
{AgBr2(NH3)}1−
- {AgBr(NH3)2}
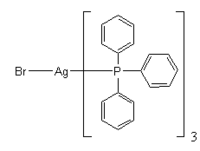
El bromuro de plata reacciona con trifenilfosfina para dar un producto tris(trifenilfosfina):[7]
Referencias
[editar]- ↑ Número CAS
- ↑ Silva, Pedro Costa (1993). Fundamentos de Fotografía. Editorial Universitaria. ISBN 9789561109148. Consultado el 23 de marzo de 2019.
- ↑ Hedgecoe, John (1992). Manual de técnica fotográfica. Ediciones AKAL. ISBN 9788487756221. Consultado el 1 de febrero de 2018.
- ↑ Manual de radiología para técnicos (10ª edición). Elsevier Health Sciences. ISBN 8490221189. Consultado el 23 de marzo de 2019.
- ↑ Rudolf Keim: Silber Teil B 2. Verbindungen mit Brom, Jod und Astat. Springer-Verlag, 2013, ISBN 978-3-662-13330-9, p. 94
- ↑ Leden, I., Persson, G.; Persson; Sjöberg; Dam; Sjöberg; Toft (1961). «The Solubility of Silver Chloride and Silver Bromide in Aqueous Ammonia and the Formation of Mixed Silver-Ammonia-Halide Complexes». Acta Chem. Scand. 15: 607-614. doi:10.3891/acta.chem.scand.15-0607.
- ↑ Engelhardt, LM; Healy, PC; Patrick, VA; White, AH (1987). «Lewis-Base Adducts of Group-11 Metal(I) Compounds. XXX. 3:1 Complexes of Triphenylphosphine With Silver(I) Halides». Aust. J. Chem. 40 (11): 1873-1880. doi:10.1071/CH9871873.