Cloruro de molibdeno(V)
| Cloruro de molibdeno(V) | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Cloruro de molibdeno(V) | ||
| General | ||
| Otros nombres | Pentacloruro de molibdeno | |
| Fórmula semidesarrollada | [MoCl5]2 | |
| Fórmula molecular | Mo2Cl10 | |
| Identificadores | ||
| Número CAS | 10241-05-1[1] | |
| ChEBI | CHEBI:30635 | |
| ChemSpider | 55417 | |
| PubChem | 61497 | |
| UNII | BB0UFP2VO5 | |
| Propiedades físicas | ||
| Apariencia | cristales verde oscuros | |
| Densidad | 2928 kg/m³; 2,928 g/cm³ | |
| Masa molar | 27 320 350 g/mol | |
| Punto de fusión | 194 °C (467 K) | |
| Punto de ebullición | 268 °C (541 K) | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de molibdeno(V) es el compuesto inorgánico de fórmula [MoCl5]2. Este sólido volátil verde oscuro se utiliza en la investigación para preparar otros compuestos de molibdeno. Es sensible a la humedad y soluble en disolventes clorados. Generalmente, llamado pentacloruro de molibdeno, de hecho es un dímero con la fórmula Mo2Cl10.[2]
Estructura
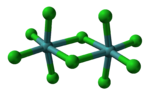
[editar]Cada átomo de molibdeno tiene simetría octaédrica local y dos cloruros forman un puente entre los centros de molibdeno.[3] También se encuentra una estructura similar para los pentacloruros de W, Nb y Ta.[4] En la fase gaseosa y parcialmente en disolución, los dímeros se disocian parcialmente para dar un pentahaluro monomérico.[5] El monómero es paramagnético, con un electrón desapareado por centro de Mo, lo que refleja el hecho de que el estado de oxidación formal es +5, dejando un electrón de valencia en el centro del metal.
Preparación y propiedades
[editar]El MoCl5 se prepara mediante cloración del molibdeno metálico, pero también por cloración de MoO3. El hexacloruro MoCl6 inestable no se produce de esta forma.[6]
En el caso de la síntesis a partir del molibdeno metálico, antes de la reacción, el polvo metálico debe calentarse a altas temperaturas en una corriente de hidrógeno o nitrógeno sin oxígeno para eliminar cualquier óxido de la superficie. Luego, debe asegurarse de que antes de la reacción real con el cloro, el aire y la humedad se eliminen por completo y se mantengan alejados de la reacción:[7]
El MoCl5 se reduce con acetonitrilo para producir un complejo de acetonitrilo naranja, MoCl4(MeCN)2. Este complejo, a su vez, reacciona con THF para dar MoCl4(THF)2, un precursor de otros complejos que contienen molibdeno.[8]
El bromuro de molibdeno(IV) se prepara mediante el tratamiento del cloruro de molibdeno(V) con bromuro de hidrógeno:
La reacción procede a través del bromuro de molibdeno(V) inestable, que libera bromo a temperatura ambiente.[9]
El MoCl5 es un buen ácido de Lewis hacia ligandos no oxidables. Forma un aducto con cloruro para formar [MoCl6]-. En síntesis orgánica, el compuesto encuentra un uso ocasional en cloraciones, desoxigenación y reacciones de acoplamiento oxidativo.[10]
Referencias
[editar]- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego, CA: Academic Press. ISBN 0-12-352651-5.
- ↑ Beck, J.; Wolf, F. (1997). «Three New Polymorphic Forms of Molybdenum Pentachloride». Acta Crystallogr. B53 (6): 895-903. doi:10.1107/S0108768197008331.
- ↑ Wells, A. E. (1984). Structural Inorganic Chemistry (5th edición). Oxford: Clarendon Press.
- ↑ Brunvoll, J.; Ischenko, A. A.; Spiridonov, V. P.; Strand, T. G. (1984). «Composition and Molecular Structure of Gaseous Molybdenum Pentachloride by Electron Diffraction». Acta Chem. Scand. A38: 115-120. doi:10.3891/acta.chem.scand.38a-0115.
- ↑ Tamadon, Farhad; Seppelt, Konrad (2013). «The Elusive Halides VCl5, MoCl6, and ReCl6». Angew. Chem. Int. Ed. 52 (2): 767-769. PMID 23172658. doi:10.1002/anie.201207552.
- ↑ A. P. Hagen (2009). «Inorganic Reactions and Methods, The Formation of Bonds to Halogens». John Wiley & Sons. ISBN 0-470-14539-0. Pág. 171
- ↑ Dilworth, Jonathan R.; Richards, Raymond L. (1990). «The Synthesis of Molybdenum and Tungsten Dinitrogen Complexes». Inorganic Syntheses. Inorganic Syntheses 28. pp. 33-43. ISBN 9780470132593. doi:10.1002/9780470132593.ch7.
- ↑ Calderazzo, Fausto; Maichle-Mössmer, Cäcilie; Pampaloni, Guido; Strähle, Joachim (1993). «Low-Temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange». J. Chem. Soc., Dalton Trans. (5): 655-658. doi:10.1039/DT9930000655.
- ↑ Kauffmann, T.; Torii, S.; Inokuchi, T. (2004). «Molybdenum(V) Chloride». Encyclopedia of Reagents for Organic Synthesis. New York, NY: J. Wiley & Sons. ISBN 9780471936237. doi:10.1002/047084289X.


