Difenilacetileno
Apariencia
| Difenilacetileno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2-feniletinilbenceno | ||
| General | ||
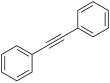
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 501-65-5[1] | |
| ChEBI | 51579 | |
| ChEMBL | CHEMBL223309 | |
| ChemSpider | 9961 | |
| PubChem | 24866731 | |
| UNII | Y70JA8HB75 | |
|
C(#Cc1ccccc1)c2ccccc2
| ||
| Propiedades físicas | ||
| Apariencia | sólido incoloro | |
| Masa molar | 178,078 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El difenilacetileno es el compuesto químico de fórmula molecular C6H5C≡CC6H5. La molécula consiste de grupos fenilos unidos como sustituyentes a los extremos del acetileno. Es un material incoloro y cristalino que es ampliamente usado en la síntesis de compuestos orgánicos y como ligando en la síntesis de compuestos organometálicos.
Preparación
[editar]Existen varias formas de preparar este compuesto::
- El bencilo es condensado con hidrazina para dar la bishidrazona, la cual es oxidada con óxido de mercurio.[2]
- El estilbeno es bromado y luego deshidrohalogenado,[3] pero el producto obtenido puede estar contaminado con estilbeno, que es difícil de eliminar.[2]
- Acoplamiento de Castro-Stephens: Este método comienza con el iodobenceno y sales de cobre del fenilacetileno
Derivados interesantes
[editar]- La reacción del Ph2C2 con ciclopentadienona tetrafenil sustituida resulta en la formación del hexafenilbenceno.[4]
- La reacción del Ph2C2 con cloruro de bencilideno en presencia de t-butóxido de potasio, da el 3-alcoxiciclopropeno que se convierte en el ion ciclopropeniato.[5]
Referencias
[editar]- ↑ Número CAS
- ↑ a b Cope, A. C.; Smith, D. S.; Cotter, R. J.. "Diphenylacetylene". Org. Synth.; Coll. Vol. 4: 377.
- ↑ Lee Irvin Smith and M. M. Falkof. "Diphenylacetylene". Org. Synth.; Coll. Vol. 3: 350.
- ↑ Fieser, L. F.. "Hexaphenylbenzene". Org. Synth.; Coll. Vol. 5: 604.
- ↑ Xu, R. Breslow, R.. "1,2,3-Triphenylcyclopropendium Bromide". Org. Synth.; Coll. Vol. 9: 730.
