Dimetilglioxima
| Dimetilglioxima | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| N,N′-Dihidroxi-2,3-butanediimina | ||
| General | ||
| Otros nombres | Diacetil dioxima; Butano-2,3-dioxime | |
| Fórmula semidesarrollada |
CH 3C(NOH)C(NOH)CH 3 | |
| Fórmula estructural |
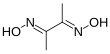 | |
| Fórmula molecular |
C 4H 8N 2O 2 | |
| Identificadores | ||
| Número CAS | 95-45-4[1] | |
| Número RTECS | EK2975000 | |
| ChEMBL | CHEMBL3184098 | |
| ChemSpider | 21159429 | |
| PubChem | 135459645 | |
| Propiedades físicas | ||
| Densidad | 1370 kg/m³; 1,37 g/cm³ | |
| Masa molar | 116,12 g/mol | |
| Punto de fusión | 514 K (241 °C) | |
| Punto de ebullición | Descompone | |
| Propiedades químicas | ||
| Solubilidad en agua | Ligeramente soluble en agua | |
| Solubilidad | Soluble en alcohol, acetona y éter | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La dimetilglioxima es un compuesto químico de fórmula CH3C(NOH)C(NOH)CH3. Su abreviatura es DmgH2 para la forma neutra y DmgH − para forma aniónica monodesprotonada. Este sólido incoloro es una dioxima derivada de la dicetona butano-2,3-diona (también conocida como diacetilo ). La DmgH2 se utiliza en el análisis de paladio o níquel . Sus complejos de coordinación tienen interés teórico como modelos para enzimas y como catalizadores. Se pueden preparar muchos ligandos relacionados a partir de otras dicetonas, como por ejemplo, bencilo .
Preparación
[editar]La dimetilglioxima se puede preparar a partir de butanona, primero mediante reacción con nitrito de etilo para dar diacetil monoxima. La segunda oxima se añade a la molécula principal utilizando sulfonato de hidroxilamina de sodio: [2]
Complejos
[editar]La dimetilglioxima forma complejos con metales como el níquel, [3] paladio y el cobalto. [4] Estos complejos se utilizan para separar esos cationes de soluciones de sus sales metálicas y en análisis gravimétricos del níquel, así como reactivo específico para la identificación de Ni(II) en el análisis cualitativo. También se utiliza en el refinado de metales preciosos para precipitar el paladio a partir de soluciones de cloruro de paladio. La reacción entre el Ni(II) y la dimetilglioxima para formar dimetilglioximato de níquel requiere un pH neutro o ligeramente básico, generalmente tamponado con amoniaco, para evitar la precipitación del hidróxido de níquel. En medio ácido no se forma el precipitado.
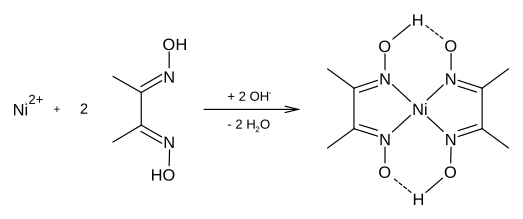

El Co(II), produce un complejo semejante, de color pardo-rojizo, soluble en medio acuoso, mientras que el Pd(II) forma el dimetilglioximato insoluble, de color amarillo, en medio ácido, que es soluble en medio básico amoniacal. Otros iones metálicos, como Fe(II) o Cu(II), también forman dimetilglioximatos solubles.[5]
Referencias
[editar]- ↑ Número CAS
- ↑ Semon, W. L. (1930). "Dimethylglyoxime". Org. Synth. 10: 22.
- ↑ Lev Tschugaeff (1905). «Über ein neues, empfindliches Reagens auf Nickel» [About a new, sensitive reagent on nickel]. Berichte der Deutschen Chemischen Gesellschaft (en alemán) 38 (3): 2520-2522. doi:10.1002/cber.19050380317.
- ↑ Girolami, G. S.; Rauchfuss, T.B.; Angelici, R. J. (1999). Synthesis and Technique in Inorganic Chemistry: A Laboratory Manual (3rd edición). pp. 213-215. ISBN 0-935702-48-2.
- ↑ Burriel Martí, F.; Lucena Conde, F.; Arribas Jimeno, S.; Hernádez Mendez, J. (1999). Química Analítica Cualitativa. Madrid: Paraninfo. p. 668. ISBN 84-283-1253-2.

