Fluorenilideno
| Fluorenilideno | ||
|---|---|---|
| General | ||
| Fórmula estructural |
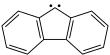 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| ChemSpider | 10617870 | |
| PubChem | 58713856 | |
| Propiedades físicas | ||
| Masa molar | 164,062600256 g/mol | |
El 9-fluorenilideno es un carbeno arilo derivado del puente de metileno del fluoreno . El fluorenilideno tiene la propiedad inusual de que el estado triplete tiene solo 1,1 kcal/mol (4,6 kJ/mol) menos de energía que el estado singlete .[1] Por esta razón, el fluorenilideno se ha estudiado extensamente en química orgánica.
El fluorenilideno es un intermedio reactivo . Las reacciones en las que interviene el fluorenilideno tienen lugar a través del carbeno en estado triplete o singulete, y los productos formados dependen de la concentración relativa de los estados de espín en la solución, según la influencia de las condiciones experimentales.[2] La tasa de cruce intersistema está determinada por la temperatura y la concentración de agentes de captura de espín específicos.[1]
Estructura
[editar]
Se cree que el estado fundamental es un triplete doblado, con dos orbitales híbridos sp ortogonales ocupados individualmente por espines no apareados.[3][4] Un electrón ocupa un orbital de simetría sigma en el plano de los anillos, mientras que el otro ocupa un orbital de simetría pi, que interactúa con los sistemas pi de los anillos aromáticos adyacentes (la deslocalización en los anillos es mínima, ya que el parámetro de campo cero D es alto).[5] Los parámetros del desdoblamiento a campo nulo predicen un ángulo de enlace superior a 135°, y dado que la geometría de enlace ideal para los carbones de ciclopentano es de aproximadamente 109°, una tensión anular considerable hace que los enlaces sigma de metileno se doblen.[5] En el estado singlete, los electrones con espín apareado ocupan el orbital híbrido sp2, ortogonal a un orbital p vacío.[6] La conversión de fluorenilideno singlete a triplete se logra a través del cruce entre sistemas.
Generación de fluorenilideno
[editar]
El fluorenilideno se puede producir por fotólisis de 9-diazofluoreno (DAF).
La fotólisis ultrarrápida (300 fs) con flash láser de DAF implica un proceso de cuatro pasos en la formación de fluorenilideno por irradiación de 9-diazofluoreno.[7]
- La irradiación de DAF produce inicialmente una molécula de diazofluoreno en estado singlete excitado ( 1 DAF*)
- 1 DAF* se desintegra para formar el carbeno de capa abierta, 1 FL*, como producto menor, y el carbeno de capa cerrada menos energético, 1 FL, como producto mayoritario.
- Cualquier singlete excitado 1 FL* en solución se relaja al estado de singlete de menor energía 1 FL (20,9 ps)
- 1 FL se equilibra con el triplete de estado fundamental 3 FL mediante el cruce entre sistemas.
Reacción de fluorenilideno en solución
[editar]El fluorenilideno reacciona con las olefinas como predicen las reglas de Skell-Woodworth.[8] La estereoquímica de los productos de cicloadición depende de las tasas relativas de ciclopropanación (u otras reacciones) y del cruce intersistemas.[9] La estabilización de estados de espín específicos y, por extensión, una mayor estereoespecificidad se pueden lograr mediante el uso de disolventes de diferentes polaridades.

Reactividad del triplete de fluorenilideno
[editar]El triplete de fluorenilideno reacciona con las olefinas de forma escalonada para producir una mezcla racémica, siempre que la velocidad de inversión de espín (cruce entre sistemas) no sea significativamente más rápida que las velocidades de rotación de enlaces intermedios.[9]
Reactividad del singlete de fluorenilideno
[editar]
El singlete de fluorenilideno reacciona con las olefinas de manera concertada, manteniendo la estereoquímica de la olefina reactiva. Los quenchers (desactivadores de fluorescencia) del triplete, como los disolventes de butadieno, se pueden usar para aumentar los rendimientos estereoespecíficos.[9] Los disolventes halogenados también estabilizan el estado singlete.[2][7] Por ejemplo, el dibromometano y el hexafluorobenceno desactivan el estado de singlete de mayor energía,[9] desacelerando la tasa de cruce entre sistemas de acuerdo con estudios anteriores de difenilcarbeno.[2] Se teoriza que el mecanismo de desactivación del estado singlete se produce a través de la formación de complejos de pares de halógenos solos de orbitales 1Fl P vacíos.[7]
Véase también
[editar]Referencias
[editar]- ↑ a b Grasse, P. B.; Brauer, B. E.; Zupancic, J. J.; Kaufmann, K. J.; Schuster, G. B. (1983). «Chemical and physical properties of fluorenylidene: equilibration of the singlet and triplet carbenes». Journal of the American Chemical Society 105 (23): 6833. doi:10.1021/ja00361a014.
- ↑ a b c Sitzmann, E. V.; Langan, J.; Eisenthal, K. B. (1984). «Intermolecular effects on intersystem crossing studied on the picosecond timescale: the solvent polarity effect on the rate of singlet-to-triplet intersystem crossing of diphenylcarbene». Journal of the American Chemical Society 106 (6): 1868-1869. doi:10.1021/ja00318a069.
- ↑ Trozzolo, A. M.; Murray, R. W.; Wasserman, E. (1962). «The Electron Paramagnetic Resonance of Phenylmethylene and Biphenylenemethylene; A Luminescent Reaction Associated With a Ground State Triplet Molecule». J. Am. Chem. Soc. 84 (24): 4990-4991. doi:10.1021/ja00883a082.
- ↑ Moritani Ichiro; Murahashi Shun-Ichi; Yoshinaga Kunio; Ashitaka Hidetomo (1967). «10, 11-Dihydro-5H-dibenzo[a, d]cycloheptenylidene». Bull. Chem. Soc. Jpn. 40 (6): 1506-1511. doi:10.1246/bcsj.40.1506.
- ↑ a b Leffler, John E. (1993). An Introduction to Free Radicals. New York: Wiley. ISBN 978-0-471-59406-2.
- ↑ Isaacs, Neil S. (1974). Reactive intermediates in organic chemistry. London: Wiley. ISBN 9780471428619.
- ↑ a b c Wang, J.; Kubicki, J.; Hilinski, E. F.; Mecklenburg, S. L.; Gustafson, T. L.; Platz, M. S. (2007). «Ultrafast study of 9-diazofluorene: Direct observation of the first two singlet states of fluorenylidene». Journal of the American Chemical Society 129 (44): 13683-13690. PMID 17935331. doi:10.1021/ja074612w.
- ↑ Skell, P. S.; Woodworth, R. C. (1956). «Structure of Carbene, CH2». Journal of the American Chemical Society 78 (17): 4496-4497. doi:10.1021/ja01598a087.
- ↑ a b c d CJ Moody; GH Whitham (1992). Reactive Intermediates. Oxford University Press.
