Naringenina
| Naringenina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
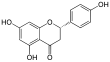
| 5,7-dihidroxi-2-(4-hidroxifenil)ciroman-4-ona | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular |
C 15H 12O 5 | |
| Identificadores | ||
| Número CAS | 480-41-1[1] | |
| ChEBI | 50202 | |
| ChEMBL | 9352 | |
| ChemSpider | 388383 | |
| DrugBank | DB03467 | |
| PubChem | 439246 | |
| UNII | HN5425SBF2 | |
| KEGG | C00509 | |
|
O=C2c3c(O[C@H](c1ccc(O)cc1)C2)cc(O)cc3O
| ||
| Propiedades físicas | ||
| Masa molar | 272,257 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La Naringenina es una flavanona, un tipo de flavonoide, que se considera que tiene un efecto bioactivo en la salud humana como antioxidante, neutralizador de radicales libres, antiinflamatorio, promotor del metabolismo de hidratos de carbono, y modulador del sistema inmune. Es la flavanona predominante en el pomelo (toronja).[2]
Efectos biológicos
[editar]In vitro reduce el daño oxidativo del ADN. La naringenina del pomelo se ha visto que tiene un efecto inhibidor en la isoforma CYP1A2 del citocromo P450 humano.[3]
También se ha comprobado que la naringenina reduce la producción de virus en hepatitis C.[4]
Parece que en ratones modificados la naringenina los protege de la obesidad en una dieta alta en grasa.[5]
También reduce el colesterol en ratas de laboratorio alimentadas con una dieta alta en colesterol.[6]
Producción natural
[editar]Pomelo, naranja, piel de tomate y tomillo[7] pero en todos los casos es difícil la absorción por ingestión oral (en el mejor de los casos sólo llega al tracto intestinal un 15% de la naringenina.[8]
Referencias
[editar]- ↑ Número CAS
- ↑ Felgines C, Texier O, Morand C, Manach C, Scalbert A, Régerat F, Rémésy C (diciembre de 2000). «Bioavailability of the flavanone naringenin and its glycosides in rats». Am. J. Physiol. Gastrointest. Liver Physiol. 279 (6): G1148-54. PMID 11093936.
- ↑ Fuhr U, Klittich K, Staib AH (abril de 1993). «Inhibitory effect of grapefruit juice and its bitter principal, naringenin, on CYP1A2 dependent metabolism of caffeine in man». Br J Clin Pharmacol 35 (4): 431-6. PMC 1381556. PMID 8485024. doi:10.1016/0024-3205(96)00417-1.
- ↑ Nahmias Y, Goldwasser J, Casali M, van Poll D, Wakita T, Chung RT, Yarmush ML (mayo de 2008). «Apolipoprotein B-dependent hepatitis C virus secretion is inhibited by the grapefruit flavonoid naringenin». Hepatology 47 (5): 1437-45. PMID 18393287. doi:10.1002/hep.22197.
- ↑ Mulvihill EE, Allister EM, Sutherland BG, Telford DE, Sawyez CG, Edwards JY, Markle JM, Hegele RA, Huff MW (octubre de 2009). «Naringenin prevents dyslipidemia, apolipoprotein B overproduction, and hyperinsulinemia in LDL receptor-null mice with diet-induced insulin resistance». Diabetes 58 (10): 2198-210. PMC 2750228. PMID 19592617. doi:10.2337/db09-0634.
- ↑ Lee SH, Park YB, Bae KH, Bok SH, Kwon YK, Lee ES, Choi MS (1999). «Cholesterol-lowering activity of naringenin via inhibition of 3-hydroxy-3-methylglutaryl coenzyme A reductase and acyl coenzyme A:cholesterol acyltransferase in rats». Ann. Nutr. Metab. 43 (3): 173-80. PMID 10545673. doi:10.1159/000012783.
- ↑ Vallverdú-Queralt, A; Odriozola-Serrano, I; Oms-Oliu, G; Lamuela-Raventós, RM; Elez-Martínez, P; Martín-Belloso, O (2012). «Changes in the polyphenol profile of tomato juices processed by pulsed electric fields». J Agric Food Chem. 60 (38): 9667-9672. PMID 22957841. doi:10.1021/jf302791k.
- ↑ Choudhury R, Chowrimootoo G, Srai K, Debnam E, Rice-Evans CA (noviembre de 1999). «Interactions of the flavonoid naringenin in the gastrointestinal tract and the influence of glycosylation». Biochem. Biophys. Res. Commun. 265 (2): 410-5. PMID 10558881. doi:10.1006/bbrc.1999.1695.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Naringenin» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
