Oxidación de Swern
La oxidación de Swern consiste en la formación de un grupo carbonilo unido a 2 cadenas laterales, dependiendo de estas puede dar lugar a una cetona o un aldehído.
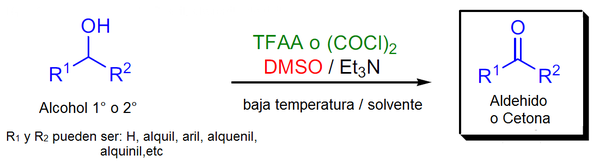
En 1976 Daniel Swern y sus colaboradores reportaron que al tratar DMSO (Dimetilsulfóxido) con Anhídrido trifluoroacético (TFAA) a -50 °C en diclorometano se producía el trifluoroacetato de trifluoroacetoxidimetilsulfonio, que reacciona fácilmente con alcoholes 1º o 2º. El trifluoroacetato de alcoxidimetilsulfonio en conjunto con la adición de trietilamina (Et3N), ocasiona una oxidación, generando los correspondientes aldehídos y/o cetonas con un buen rendimiento.
En 1978 se introduce el cloruro de oxalilo[1] , que demuestra ser mucho más efectivo frente al TFAA como agente activador del DMSO [2] durante la oxidación de alcoholes.[3]
Características generales de la reacción
[editar]- El DCM (Diclorometano) es el solvente más común
- El procedimiento típico comienza con la reacción entre DMSO con cloruro de oxalilo (o TFAA) a baja temperatura, seguido por la adición lenta del alcohol, y a continuación, de una amina terciaria (por ejemplo, DIPA= diisopropilamina o TEA= trietanolamina)
- La adición de esta amina terciaria es necesaria para facilitar la descomposición de la sal alkoxisulfonio que se forma durante el proceso
- La eficiencia de la oxidación no es influenciada por el impedimento estérico del sustrato
- Generalmente se trabaja a bajas temperaturas (-78 °C)
Precauciones
[editar]- Cuando no se utiliza un solvente, el DMSO reacciona de manera violenta (causando una explosión) con el cloruro de oxalilo o con el TFAA.
- Cuando se emplee el TFAA, el primer intermediario es inestable por encima de -30 °C formando un producto secundario a través de una reacción denominada reordenamiento de Pummerer.
- Al emplear cloruro de oxalilo, el primer intermediario es inestable por encima de -60 °C, por lo que la oxidación se realiza generalmente a -78 °C.
- El uso de TFAA puede dar lugar a productos secundarios, mientras que en el caso del cloruro de oxalilo los subproductos son extremadamente raros.
Mecanismo
[editar]Consiste de tres pasos a seguir:
En la primera etapa (a temperaturas inferiores a -30 °C) el dimetilsulfóxido (DMSO) ataca nucleofílicamente al anhídrido trifluoroacético, expulsando así una unidad de trifluoroacetato, que queda unida al intermediario trifluoroacetoxidimetilsulfonio, luego, mediante un rearreglo de Pummerer (temperaturas superiores a -30 °C) se forma un producto secundario.
En la segunda etapa, el alcohol (1° o 2°) ataca al átomo de azufre sobre el producto secundario, con el consecuente reordenamiento y expulsión de una molécula de ácido trifluoroacético, formando así una sal de alcoxisulfonio, que luego pierde un hidrógeno por ataque de la amina terciaria, dejando finalmente un iluro de alcoxisulfonio
Finalmente, un reordenamiento intramolecular en el iluro, conlleva a la expulsión del tioeter, y a la liberación del aldehído o cetona correspondiente.
Mecanismo alternativo
[editar]Este mecanismo procede con cloruro de oxalilo en lugar de anhídrido trifluoroacético, siendo empleado con mayor frecuencia. Básicamente consta de lo siguiente:
En el primer paso, el dimetilsulfóxido ataca uno de los grupos carbonilo del cloruro de oxalilo, conllevando así a la expulsión de un ion cloruro, el cual atrapa la unidad de dimetilsulfóxido, creando así una sal de clorosulfonilo, con dióxido y monóxido de carbono como subproductos.
En el segundo paso, el alcohol ataca a la sal de clorosulfonio, con la pérdida de ácido clorhídrico (HCl), luego la amina terciaria interviene, abstrayendo un protón (átomo de hidrógeno) correspondiente al intermediario formado, liberando al iluro de alcoxisulfonio.
Finalmente, el tercer paso procede mediante reordenamiento intramolecular en el iluro, conllevando a la expulsión del tioeter, y a la liberación del aldehído o cetona correspondiente.
Referencias
[editar]- ↑ Omura, K.; Swern, D. (1978). «Oxidation of alcohols by "activated" dimethyl sulfoxide. A preparative, steric and mechanistic study». Tetrahedron 34 (11): 1651. doi:10.1016/0040-4020(78)80197-5.
- ↑ Mancuso, A. J.; Huang, S.-L.; Swern, D. (1978). «Oxidation of long-chain and related alcohols to carbonyls by dimethyl sulfoxide "activated" by oxalyl chloride». J. Org. Chem. 43 (12): 2480-2482. doi:10.1021/jo00406a041.
- ↑ Mancuso, A. J.; Brownfain, D. S.; Swern, D. (1979). «Structure of the dimethyl sulfoxide-oxalyl chloride reaction product. Oxidation of heteroaromatic and diverse alcohols to carbonyl compounds». J. Org. Chem. 44 (23): 4148-4150. doi:10.1021/jo01337a028.





