Proceso de contacto
El proceso de contacto es un proceso para la producción de ácido sulfúrico por medio de un catalizador (usualmente, pentóxido de vanadio en sílice). El método lo patentó Peregrine Phillips[1][2] en 1831.[3][4] Se ha aplicado a escala industrial, este método ha evolucionado y se emplea la versión doble más rentable y ecológica. Anteriormente también se utilizaba el proceso de cámaras de plomo y el proceso del vitriolo.[4]
Descripción del proceso
[editar]En el primer paso es producir dióxido de azufre por la combustión de azufre con el oxígeno del aire. El aire empleado en la combustión debe ser lo suficientemente seco, para evitar la corrosión y la desactivación del catalizador, con lo que el producto resultante sería anhídrido sulfuroso.
La combustión de azufre está en exceso de aire en un horno con un revestimiento refractario a un gas con aproximadamente 10 a 11% de contenido de azufre. La temperatura del gas después de la combustión debe bajarse hasta aproximadamente 410 a 440 °C para la subsiguiente etapa de la oxidación catalítica.
El dióxido de azufre también se puede producir tostando minerales sulfuros como la pirita.
El dióxido de azufre reacciona con oxígeno en presencia de un catalizador, de platino - o vanadio - (en gel de sílice SiO2), en una reacción de equilibrio a trióxido de azufre. La misión del catalizador es aumentar la velocidad de reacción pero no cambia el punto de equilibrio. De acuerdo con el principio de Le Chatelier, una temperatura más baja desplaza el equilibrio químico hacia la derecha, por lo tanto, aumenta el rendimiento porcentual. Si al bajar la temperatura también baja la velocidad de formación pudiendo llegar a un nivel antieconómico. Como compromiso entre los dos condicionantes las altas temperaturas se sitúa entorna a los 450 °C, las presiones medias entre 1 a 2 atm. Como la reacción es exoterma después de pasar por una bandeja de catalizador el gas se saca del reactor y se enfría hasta los 400 °C antes de volver a introducirlo, para conseguir el proceso lo más isotermo posible.
Aunque se podría hacer reaccionar el trióxido de azufre resultante con agua para formar ácido sulfúrico.
Pero no se hace debido a que es una reacción fuertemente exotérmica y haría hervir la mezcla produciendo vapores o nieblas ácidas. En su lugar se aprovecha que el SO3 tiene una mayor solubilidad en H2SO 4 que en el agua. Esto crea óleum (también conocido como ácido sulfúrico fumante):
Este se puede mezclar con agua para obtener el doble de ácido sulfúrico.
Como norma las plantas de ácido sulfúrico más, que la solución de SO3 sobre 97 a 99% de fuerza se utiliza ácido sulfúrico, y la concentración de ácido sulfúrico por adición de agua se ajusta de modo que no se forme nada de ácido sulfúrico fumante. En algunas plantas de ácido sulfúrico también se hace consciente de óleum, que luego no se diluye con agua, sino que se utiliza para usos específicos.
Es importante que en la reacción de dióxido de azufre con oxígeno para dar trióxido de azufre la temperatura no salga del rango de 400-700 °C. Por debajo de los 400 °C el catalizador no es efectivo y por encima de 700 °C los materiales del reactor sufren demasiado estrés.
Fuentes del SO2
[editar]Para este proceso se puede agrupar en dos formas de obtener el SO2 uno por la quema de azufre nativo y la otra mediante sustancias en el que el azufre aparece con impurezas: la tostación de piritas, la regeneración de ácido sulfúrico gastado, el ácido sulfhídrico. Esto condiciona la pureza del SO2.
La producción de ácido sulfúrico por combustión de azufre elemental presenta un mejor balance energético pues no tiene que ajustarse a los sistemas de depuración tan rígidos forzosamente necesarios en las plantas de tostación de piritas. Primero de debe secar el aire de combustión, es decir quitarle la humedad para lo cual se pasa por una torre de secado. Esta consiste en una ducha de ácido sulfúrico donde se aprovecha la gran avidez de este por el agua. Al salir del horno después de la combustión se pasa por una caldera con el fin de bajar su temperatura, el calor retirado se emplea para fundir el azufre que se va a quemar. A continuación se pasa por un filtro para retirar las cenizas y posibles sólidos.
EL caso más extremo se trata del tostado de piritas, una fuente con muchas impurezas, el proceso de purificación es más complejo lo que influyen sensiblemente sobre el rendimiento general de la planta. El aire para la combustión se seca de la misma forma, pero después de la combustión se separan las cenizas mediante un filtro. El polvo producido en el proceso de tostación nunca puede eliminarse en su totalidad y, junto con las impurezas, principalmente arsénico y antimonio. Estos pueden envenenar al catalizador lo que haría disminuir el rendimiento. Después pasa por una torre de lavado que mediante una ducha de ácido sulfúrico débil al 5% se limpia y enfría el gas. Después pasa a una torre de secado mediante una ducha de ácido sulfúrico concentrado. Existen diversos filtros para eliminar sustancias perjudiciales como el arsénico. Antes de introducir el gas en el reactor catalítico se ajusta la temperatura.
Cuando se parte de ácido sulfúrico gastado o ácido sulfhídrico se debe mantener la temperatura de la llama elevada para asegurar la total conversión en SO2 lo cual puede implicar el empleo de algún combustible.
Catálisis
[editar]La etapa de reacción esencial es la oxidación de dióxido de azufre con aire oxígeno a trióxido de azufre con la ayuda un catalizador. El mejor es el platino pero tiene dos inconvenientes que hace que no se emplee, el primero, es muy susceptible a la impurezas especialmente de arsénico y se envenena rápidamente y el segundo, es muy caro. Por eso el catalizador empleado normalmente es el pentóxido de vanadio. La empresa BASF patentó el empleo de pentóxido de vanadio en 1913[5] Los reactores suelen tener cuatro bandejas de reacción. Como la reacción es exotérmica a la salida de cada bandeja el gas se envía a un intercambiador de calor para disminuir la temperatura y entre en la siguiente bandeja a la temperatura óptima.
El pentóxido de vanadio se encuentra en los poros de la tierra de diatomeas incluye como un sólido, pero se disuelve en el estado activo en una masa fundida de sulfato de metal alcalino. La temperatura de fusión del sulfato de metal alcalino, por lo tanto, es límite inferior de funcionamiento del catalizador. Se estudia el empleo de catalizador de cesio que tiene una temperatura límite inferior más abajo, lo que permite disminuir la temperatura final de los gases y no hacer sufrir al acero tanto estrés.[6][7]
Se puede considerar que el proceso de catálisis ocurre en dos etapas con un total de dos moléculas de dióxido de azufre para reaccionar con el oxígeno a trióxido de azufre. El mecanismo de la acción del catalizador comprende dos pasos:
1. La oxidación del SO2 en SO3 por V5+ :
2. La oxidación de V 4 + nuevo en V 5 + por el oxígeno (regeneración del catalizador):
Pero el proceso real es algo más complejo pasando por un complejo de composición [(VO)2O(SO4)4]4-. En este el oxígeno se deposita primero, seguido por el dióxido de azufre.
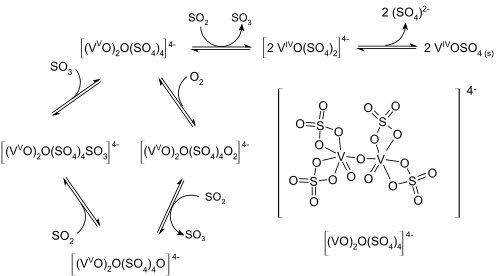
A veces también se emplea óxido de hierro como catalizador pero se obtiene peores resultados.
Variación de doble contacto
[editar]El proceso de doble contacto para la producción de ácido sulfúrico es una evolución del proceso de contacto, pero mejorado en la parte medio ambiental y por tanto se utiliza ahora industrialmente.
En contraste con el método de contacto simple, el gas, mezcla de SO2 y SO3, después de paso a través de tres bandejas de catálisis va a una torre de absorción intermedia donde con ácido sulfúrico al 98% se absorbe la mayoría del SO3. El pequeño porcentaje no absorbido junto con el SO2 pasan por una cuarta bandeja. Donde se convierte la mayor parte del SO2 en SO3 ya que el equilibrio se ve favorecido según el principio de Le Chatelier. Y a continuación pasa por otra torre de absorción. El rendimiento obtenido es por lo menos 99,8%. Un pequeño porcentaje de SO2 y trazas de SO3 se lanza a la atmósfera.
Como la temperatura en la torre de absorción debe ser relativamente baja, pero el gas de retorno al reactor debe estar a unos 400 °C existe una serie de intercambiadores de calor intermedios con el fin de ajustar las temperaturas y aprovechar el calor.

Referencias
[editar]- ↑ Nature. «Peregrine Phillips, the Inventor of the Contact Process for Sulphuric Acid» (en inglés). Consultado el 21 de julio de 2012.
- ↑ Oxford Dictionary of National Biography. «Peregrine Phillips». Archivado desde el original el 8 de marzo de 2016. Consultado el 21 de julio de 2012.
- ↑ «The First catalysts». Springer (en inglés). Consultado el 21 de julio de 2012.
- ↑ a b «The History of the Contact Sulfuric Acid Process» (en inglés). Consultado el 21 de julio de 2012.
- ↑ «contact». Consultado el 21 de julio de 2012.
- ↑ «Super Cesium» (en inglés). Consultado el 21 de julio de 2012.[ ]
- ↑ «Sulphuric Acid Plants» (en inglés). Archivado desde el original el 9 de mayo de 2012. Consultado el 21 de julio de 2012.











