Tubo neural
El tubo neural[1] o epineura es una estructura que se desarrolla en el embrión de los vertebrados, y que dará lugar al sistema nervioso central (encéfalo y médula espinal). De forma cilíndrica, se forma por invaginación a partir de la región dorsal del ectodermo, también llamada placa neural, inducida por la notocorda mientras esta se está formando. Aparece al inicio de la tercera semana de la concepción por un proceso llamado neurulación.
Se trata de una estructura fluida y tubular (contiene líquido cefalorraquídeo y células ciliadas) que sufre modificaciones en los diferentes subfilos de los cordados:
- En los urocordados desaparece quedando solamente unos ganglios.
- En los cefalocordados dará lugar a las crestas neurales, que formarán el sistema nervioso del organismo.
- En los craneados (vertebrados) el extremo anterior se ensancha formando el sistema nervioso central y es protegido por los huesos del cráneo y las vértebras. Además se forma la cresta neural, exclusiva de este grupo, que aparece cuando se cierra el tubo dorsal; la cresta neural está formada por células migrantes que pueden dar lugar a muchos tipos celulares (pigmentación, glándulas, mandíbulas,...)
Fases de desarrollo
[editar]La inducción neural
[editar]El embrión en su desarrollo entra en el proceso de la gastrulación, donde se formarán las tres capas germinativas conocidas como el ectodermo, mesodermo y endodermo. Es en esta primera capa, en el ectodermo, donde se formarán las células del sistema nervioso central y se dará el desarrollo del sistema nervioso así como la previa inducción neural.
La inducción neural se inicia con una señalización en el ectodermo por parte del tejido adyacente en la etapa de la gástrula del embrión, para que las células presentes se convierten en células madres neurales, y se forme el neuroectodermo, adquiriendo de ese modo un destino nuevo. Consecuentemente este tejido participará en la formación de la placa neural, los pliegues neurales y el desarrollo del tubo neural, denominado neurulación. De esta forma, podemos verlo como 2 pasos consecutivos: la inducción neural para marcar el territorio neural del ectodermo, y en segundo lugar, la formación de estructuras neurales iniciales (tubo neural y cresta neural) a partir de las cuales se desarrollarán todas las que configuran el sistema nervioso.
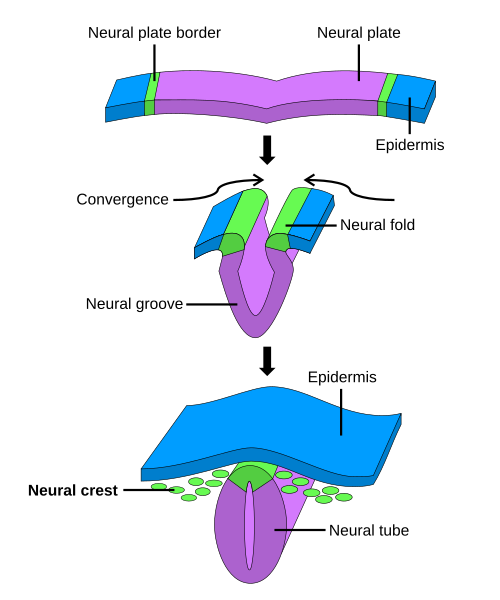
En primer lugar, la formación del neuroectodermo y sus límites, tiene lugar cuando en el mesodermo se forma la notocorda: prolongación precursora de la columna vertebral que define el eje céfalo-caudal del embrión, la cual establece con el ectodermo una intensa interacción fundamental para el proceso de la inducción neural. Se aseñala que la parte del mesodermo que contiene la notocorda envía unas señales inductoras al ectodermo desencadenando su diferenciación como neuroectodermo. Es así como, inmediatamente sobre la notocorda, el ectodermo se engruesa para formar la placa neural. Los bordes de esta placa sobresalen, se pliegan y se unen por encima formando un largo tubo: el tubo neural.
[2]
Este tubo da lugar a la mayor parte del sistema nervioso, en su sector anterior se ensancha y se diferencia en el encéfalo y los nervios craneales; en su sector posterior forma la médula espinal y los nervios motores. La mayor parte del Sistema nervioso periférico (SNP) deriva de las células de la cresta neural, que emigran antes de que el tubo neural se cierre.
En la cresta neural se originan los nervios craneales, células de pigmento, cartílago y huesos de la mayor parte del cráneo, incluidas las mandíbulas, ganglios del Sistema Nervioso Autónomo (SNA), y la médula de las glándulas adrenales.
- Para regular esta inducción, los centros organizadores son cruciales, pues, son regiones restringidas y especializadas para inducir la especificación regiones. Un ejemplo equivale es el organizador de Spemann. Investigaciones con Spemann proponen que las zonas del ectodermo que reciban señales inductoras formaran el neuroectodermo, mientras que el resto del ectodermo, al no recibir estas señales, se desarrolla como tejido epidérmico (piel) y no como SN. Es aquí cuando entran en juego todas las moléculas que permiten el destino neural, regulado por FGFs, inhibidores de Wnt i inhibidores de BMP.
Neurulación
[editar]El proceso en el que se genera y cierra del tubo neural empieza a partir de la tercera semana de gestación y debería terminar de cerrarse aproximadamente alrededor del vigésimo octavo día. Inicialmente el tubo está abierto en sus extremos, formándose los poros rostral y caudal, pero a partir de la cuarta semana comienzan a cerrarse. Este cierre y el desarrollo del tubo generará varias dilataciones en su parte rostro-craneal, que en el futuro configura las diferentes partes del encéfalo. Generalmente se cierra primero el extremo craneal (anterior), alrededor del día 25, mientras que el caudal (posterior) suele cerrar alrededor del día 28.
La placa neural se estira de manera cefalocaudal, de tal manera que va generando pliegos, que con el desarrollo del feto irán creciendo. Se produce con el tiempo un hundimiento de la parte central, generando una cadena las paredes irán cerrándose sobre sí mismas hasta generar un estructura en forma de tubo: el tubo neural. Este tubo empieza a cerrarse sobre sí mismo por la parte media, avanzando hacia los extremos.
Los dos mecanismos principales para pasar de la placa neural a la formación del tubo neural son: - La neurulación primaria: en la que las células que se encuentran envolviendo la placa neural empiezan a dirigir a las células de la placa neural a expandirse, invaginarse y separarse. - La neurulación secundaria: en que parte del tubo neural correspondiente a la columna vertebral se forma al tiempo se ablanda de tal manera que se vacía la cavidad interna de dicho tubo, generando una separación entre epitelio y células mesenquimales (las que formarán el cordón medular). En la médula encontramos que en la parte ventral aparecen las neuronas motoras, mientras que las sensoriales aparecen en la parte más dorsal de esta.
El tubo neural se constituye por la unión de dos tubos que se producen independientemente, a través de diferentes procesos morfogenéticos y moleculares. Generalmente, su parte anterior se desarrollará por neurulación primaria y la posterior para neurulación secundaria. Una vez que se forma el tubo neural inicial, hay cuatro etapas de subdivisiones que tienen lugar antes de que se complete el sistema nervioso central final. Estas divisiones son instigadas por las células neuroepiteliales, y las divisiones tienen lugar en el prosencéfalo, mesencéfalo, el rombencéfalo y la médula espinal. Al final de estas subdivisiones, hay un cerebro, columna vertebral y médula espinal identificables que continuarán desarrollándose durante el embarazo y los primeros años de vida.
En la neurulación una vasta región central de ectodermo, denominada placa neural, se engruesa, se enrolla en un tubo y se desprende del resto de la hoja celular. Este tubo surgido del ectodermo se llama tubo neural, formará el cerebro y la médula espinal.
La mecánica de la neurulación depende de los cambios en el empaquetamiento y forma celulares que hacen que el epitelio se enrolle en un tubo. Unas señales inicialmente procedentes del Organizador y más tarde de la notocorda subyacente y del mesodermo definen la extensión de la placa neural, inducen los desplazamientos responsables del enrollamiento y ayudan a organizar el patrón interno del tubo neural. Concretamente, la notocorda segrega la proteína Sonic hedgehog, una homóloga de la proteína señal Hedgehog de Drosophila, que actúa como morfógeno controlando la expresión génica en los tejidos vecinos.
Embriología animal
[editar]Casi siempre las neuronas se producen asociadas con células gliales, las cuales constituyen el armazón de soporte y generan un medio cerrado y protector en el que pueden desempeñar su función. En todos los animales, ambos tipos celulares surgen del ectodermo, normalmente como células hermanas de un precursor común. Así, en los vertebrados las neuronas y las células gliales del SNC derivan de un parte del ectodermo que se enrolla formando el tubo neural, mientras que las del SNP derivan sobre todo de la cresta neural.
El tubo neural está formado inicialmente por un epitelio monoestratificado. Las células epiteliales son las progenitoras de las neuronas y de la glía. Mientras se generan estos tipos celulares, el epitelio se engruesa y se transforma en una estructura más compleja. Las células progenitoras y, más tarde las células gliales, mantienen la cohesión del epitelio y forman un armazón que atraviesa todo su grosor. Las neuronas recién nacidas migran y envían sus axones y sus dendritas a lo largo y entre estas células.
Las proteínas señal, secretadas por la zona dorsal y ventral del tubo neural, actúan como morfógenos opuestos, haciendo que las neuronas nazcan en diferentes niveles dorsoventrales expresando diferentes proteínas reguladoras de genes. También existen diferencias a lo largo del eje cabeza-cola, reflejando el patrón anteroposterior de expresión de los genes hox y las acciones de otros morfógenos. Además, las neuronas continúan generándose en cada región del SNC, durante muchos días, semanas o meses, lo cual aumenta aún mucho más su diversidad, ya que las células adoptan diferentes caracteres de acuerdo con su fecha de «nacimiento», el momento de la mitosis terminal que marca el comienzo de la diferenciación neuronal[cita requerida].
Diferenciación
[editar]La diferenciación del tubo neural se produce simultáneamente a nivel anatómico, a nivel tisular y a nivel celular.[3] A nivel anatómico tanto el tubo neural como su cavidad sobresalen y se estrechan para formar las cavidades de la médula espinal y del cerebro. A nivel tisular, las células dentro de la pared del tubo neural se reubican formando las diferentes regiones del sistema nervioso central. Finalmente, a nivel celular, se da el proceso de diferenciación celular en el que las células neuroepiteliales se diferencian en neuronas y células gliales.[3]
Eje anteroposterior
[editar]En el tubo neural temprano, la porción más anterior se dilata en tres vesículas primarias: el cerebro anterior (prosencéfalo), el cerebro medio (mesencéfalo) y el cerebro posterior (rombocéfalo).[3]

El prosencéfalo, a su vez se subdivide en telécefalo (anterior) y diencéfalo (caudal). El telencéfalo formará los hemisferios cerebrales, hipocampo y lóbulos olfatorios. Por su parte, el destino del diencéfalo será formar la retina, parte de la hipófisis: el infundibulo y la neurohipofisis, el epitálamo, el tálamo y el hipotálamo.[4] El mesencéfalo no se subdivide y su cavidad se convierte en el cerebro medio. El rombocéfalo se subdivide en el mielencéfalo (posterior) y en el metencéfalo (anterior). El mielencéfalo llega a ser el bulbo raquídeo y el metencéfalo da origen tanto al cerebelo como al puente troncoencefálico.[4] El rombocéfalo se divide en cavidades pequeñas llamadas rombómeras. Cada rombómera tiene un destino de desarrollo diferente. De estas estructuras se originarán ganglios y nervios craneales.[3]
Todo el establecimiento del eje anteroposterior del sistema nervioso central es dirigido por una serie de genes que incluyen a los complejos de genes Hox.[3]
Eje dorsoventral
[editar]El tubo neural está polarizado a lo largo del eje dorsoventral. En la región ventral se ubican las neuronas motoras, mientras que en la región dorsal se encuentran las neuronas comisurales que envían axones a través de la médula espinal. Dicha polaridad es inducida por señales provenientes de tejidos adyacentes.[5] El patrón ventral es inducido por la notocorda, mientras que el patrón dorsal es provocado por la epidermis.[3]
Esta especificación es disparada por dos factores paracrinos principales. El primero es la proteína, originada desde la notocorda y el segundo es un grupo de proteínas TGF-β provenientes del ectodermo dorsal. induce a las células bisagra mediales a convertirse en la placa del piso del tubo neural (región ventral). Una vez diferenciadas, las células de la placa del piso también secretan, creando un gradiente donde la concentración más fuerte se encuentra en la parte más ventral. La región dorsal es establecida por proteínas de la superfamilia TGF-β, específicamente BMP4 y BMP7. Tan pronto se establecen las células de la placa del suelo sobre el lado ventral, la epidermis genera un centro de señalización secundario induciendo la expresión de BMP4 en las células de la placa del techo del tubo neural. A su vez, BMP4 desde la placa del techo induce una cascada de proteínas TGF-β en las células adyacentes. De esta manera, diferentes grupos de células son expuestos a distintas concentraciones de las proteínas TGF- β a diferentes tiempos (lo más dorsal es expuesto a más factores en altas concentraciones y en tiempos tempranos).[3]
Estos determinantes paracrinos interactúan para generar la síntesis de distintos factores de transcripción a lo largo del eje dorsoventral del tubo neural. Las células adyacentes a la placa del piso reciben altas concentraciones de y bajas concentraciones de TGF-β, como resultado, sintetizan factores de transcripción Nkx6.1 y Nkx2.2 convirtiéndose en neuronas ventrales (V3). Las células dorsales son expuestas a menos y a más de TGF-β, por lo que sintetizan factores de transcripción Nkx6.1 y Pax6. Finalmente, los dos grupos de células que reciben progresivamente menos se convierten en las interneuronas V2 y V1.[6]
Véase también
[editar]Bibliografía
[editar]- Kennneth, Kardong (2007). Vertebrados: Anatomía comparada, función y evolución, 4ª Edición. McGraw Hill.
Referencias
[editar]- ↑ OMS,OPS,BIREME (ed.). «Tubo neural». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ Alan R Crossman; David Neary (2019). «1:Introducción». Neuroanatomía, Texto y Atlas en Color. Elsevier Health Sciences. pp. 5-7.
- ↑ a b c d e f g Gilbert SF (2005). «Biología del Desarrollo». Editorial Médica Panamericana, Inc. (7 edición). pp. 426-429.
- ↑ a b Felten David L. & Shetty Anil N. (2010). «Atlas de Neurociencia». ElSevier España, S.L. pp. 116-120.
- ↑ Wolpert Jessel et. al. (2007). Principios del Desarrollo. Tercera Edición, Capítulo 10. Madrid: Editorial Médica Panaméricana S.A.
- ↑ Lee, S.K & Pfaff S.L. (2001). Transcriptional networks regulating neuronal identity in the developing spinal cord. Nature Neuroscience. Suppl. (4) 1183-1191