Нитрат уранила: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
м единообразие шрифтов в хим.формулах, replaced: \mathrm{ → \mathsf{ (6) с помощью AWB |
MBHbot (обсуждение | вклад) м →top: РДБ-запрос, replaced: еакционоспособност → еакционноспособност |
||
| (не показано 35 промежуточных версий 21 участника) | |||
| Строка 1: | Строка 1: | ||
{{Вещество |
|||
'''Урани́л азотноки́слый''', азотнокислая окись [[Уран (элемент)|урана]]: |
|||
| заголовок = <!-- по умолчанию = названию статьи; можно не заполнять --> |
|||
| картинка = |
|||
| картинка3D = |
|||
| изображение = Uranyl nitrate.jpg |
|||
| наименование = Уранила нитрат |
|||
<math>~\mathsf{UO_2(NO_3)_2}</math> (безводный); <math>~\mathsf{UO_2(NO_3)_2 \cdot 6H_2O}</math> (кристаллогидрат). |
|||
| традиционные названия = Азотнокислый уранил |
|||
| сокращения = <!-- принятые сокращения названия --> |
|||
| хим. формула = UO<sub>8</sub>N<sub>2</sub> |
|||
| рац. формула = UO<sub>2</sub>(NO<sub>3</sub>)<sub>2</sub> |
|||
| состояние = твёрдое, кристаллическое |
|||
[[Молекулярный вес]] безводной формы 394,04; [[кристаллогидрат]]а 502,13. |
|||
| примеси = <!-- типичное кол-во, указать единицы --> |
|||
| молярная концентрация = <!-- число, в моль/л --> |
|||
| молярная масса = 394,04(безводн.); 502,13(гексагидрат) |
|||
| плотность = 3,35 г/см3 (дигидрат) |
|||
| предел прочности = <!-- число, в Н/мм² --> |
|||
| твёрдость = <!-- число (безразм.) --> |
|||
| поверхностное натяжение = <!-- число, Н/м --> |
|||
| динамическая вязкость = <!-- число, в Па·с (при 20 °C) --> |
|||
| кинематическая вязкость = <!-- число, в см²/с (при 20 °C) --> |
|||
| скорость звука = <!-- число, в м/с --> |
|||
| энергия ионизации = <!-- число, в кДж/моль --> |
|||
| проводимость = <!-- число (удельная проводимость), в сименсах/м --> |
|||
| уд. электр. сопротивление = <!-- число, в Ом·м --> |
|||
| коэфф. электр. сопротив. = <!-- число (темп. коэфф. эл. сопротивл.), в К^-1 --> |
|||
| темп. плавления = <!-- число, в °C --> |
|||
Роль [[металл]]а в этой соли исполняет [[катион]] [[уранил]]а <math>~\mathsf{[UO_2]^{2+}}</math>. |
|||
| температура размягчения = <!-- число, в °C для аморфных веществ --> |
|||
| темп. кипения = <!-- число (по умолчанию, в °C, можно добавлять давление, |
|||
другие условия и единицы измерения) --> |
|||
| темп. сублимации = <!-- число, в °C — для сублимирующихся веществ --> |
|||
| темп. разложения = 100°C |
|||
| темп. вспышки = <!-- число, в °C --> |
|||
| фазовые переходы = <!-- числа через запятую, с указанием единиц изм. --> |
|||
| темп. стеклования = <!-- число, в °C --> |
|||
| темп. воспламенения = <!-- число, в °C --> |
|||
| темп. самовоспламенения = <!-- число, в °C --> |
|||
| пределы взрываемости = <!-- число, % --> |
|||
| тройная точка = <!-- ? K (? °C), ? Па --> |
|||
Кристаллы жёлтого цвета с зеленоватым отблеском, легко растворимые в воде. Водный раствор имеет кислую реакцию. Также растворим в [[этанол]]е, [[ацетон]]е и [[Диэтиловый эфир|эфире]], нерастворим в [[бензол]]е, [[толуол]]е и [[хлороформ]]е. |
|||
| критическая точка = <!-- ? K (? °C), ? Па --> |
|||
| критическая темп. = <!-- число, в °C --> |
|||
| критическое давление = <!-- число, по умолчанию в атм --> |
|||
| критическая плотность = <!-- число, в см³/моль --> |
|||
| теплоёмкость = <!-- число, в Дж/(моль·К) (молярная теп.-ём.) --> |
|||
| теплоёмкость2 = <!-- число, в Дж/(кг·К) (удельная теп.-ём.) --> |
|||
| теплопроводность = <!-- число, в Вт/(м·K) --> |
|||
| энтальпия образования = 1987 |
|||
| энтальпия плавления = <!-- число, по умолчанию в кДж/моль --> |
|||
| энтальпия кипения = <!-- число, по умолчанию в кДж/моль --> |
|||
| энтальпия растворения = <!-- число, по умолчанию в кДж/моль --> |
|||
| энтальпия сублимации = <!-- число, по умолчанию в кДж/моль --> |
|||
| удельная теплота парообразования = <!-- число, по умолчанию в Дж/кг --> |
|||
| удельная теплота плавления = <!-- число, по умолчанию в Дж/кг --> |
|||
| тепловое расширение = <!-- число (безразм.) --> |
|||
| интервал трансформации = <!-- число, в ° --> |
|||
| давление пара = <!-- число (с указанием ед. изм!); |
|||
можно добавить любой текст --> |
|||
| константа В. дер В. = <!-- число --> |
|||
| конст. диссоц. кислоты = <!-- число (безразм.) --> |
|||
При нагревании кристаллы плавятся и выделяют [[Азотная кислота|азотную кислоту]] и воду. |
|||
| растворимость = <!-- число, по умолчанию в г/100 мл --> |
|||
Кристаллогидрат легко выветриваются на воздухе. |
|||
| растворимость1 = 119 г/100 мл |
|||
| вещество1 = воде, 20°C |
|||
| растворимость2 = 138 г/100 мл |
|||
| вещество2 = воде, 30°C |
|||
| растворимость3 = растворим |
|||
| вещество3 = ацетоне |
|||
| растворимость4 = растворим |
|||
| вещество4 = этаноле |
|||
| вращение = <!-- число, в ° --> |
|||
| изоэлектрическая точка = <!-- число (безразм.) --> |
|||
| от. диэлектр. прониц. = <!-- число --> |
|||
| диапазон прозрачности = <!-- число-число, в нм --> |
|||
Характерная реакция — при действии [[аммиак]]а образуется жёлтый осадок урановокислого [[Аммоний|аммония]]. |
|||
| показатель преломления = <!-- число (безразм.) --> |
|||
| угол Брюстера = <!-- число, в ° --> |
|||
| гибридизация = <!-- ? --> |
|||
Обладает свойством дубить [[желатин]]. |
|||
| координационная геометрия = <!-- ? --> |
|||
Ядовит. |
|||
| кристаллическая структура = <!-- описание решётки --> |
|||
| дипольный момент = <!-- число, в дебаях --> |
|||
| CAS = <!-- № по CAS --> |
|||
== Применение == |
|||
| PubChem = <!-- № по PubChem --> |
|||
В [[Фотография|фотографии]] на основе солей [[Серебро|серебра]] применяется как усилитель [[негатив]]ов и для тонирования готовых отпечатков (рецепт на основе азотнокислого уранила окрашивает фотоснимок в красно-коричневые тона). При этом часть серебра в изображении заменяется на железосинеродистый уранил |
|||
| EINECS = <!-- № по EINECS --> |
|||
<math>~\mathsf{(UO_2)_2[Fe(CN)_6]}</math>. |
|||
| SMILES = <!-- Хим. формула по SMILES --> |
|||
| RTECS = <!-- № по RTECS --> |
|||
| ChEBI = <!-- № по ChEBI --> |
|||
| ООН = <!-- № по ООН (UN) --> |
|||
| ПДК = <!-- число или список чисел, указать ед. измерения! --> |
|||
Реакции протекают по уравнениям: |
|||
| ЛД50 = <!-- число, по умолчанию в мг/кг, можно с уточнениями --> |
|||
| токсичность = Высокотоксичен, радиоактивен |
|||
| R-фразы = <!-- фразы, в двойных фигурных скобках, через запятую --> |
|||
| S-фразы = <!-- фразы, в двойных фигурных скобках, через запятую --> |
|||
| H-фразы = <!-- {{H-фразы|H201|H202|H235+H410}} --> |
|||
| P-фразы = <!-- {{P-фразы|P201}} --> |
|||
| сигнальное слово = <!-- слово Опасно или Осторожно (если есть) --> |
|||
| СГС = <!-- Пиктограммы СГС: {{СГС|Баллон|Бомба}} --> |
|||
| NFPA 704 = <!-- раскомментировать при использовании |
|||
{{NFPA 704 |
|||
| опасность для здоровья = 3 |
|||
| огнеопасность = 0 |
|||
| реакционноспособность = 0 |
|||
| прочее = RAD |
|||
}}--> |
|||
}} |
|||
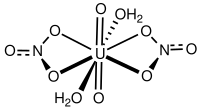
'''Урани́л азотноки́слый''' — [[неорганическое соединение]], азотнокислая окись [[Уран (элемент)|урана]]. Имеет формулу UO<sub>2</sub>(NO<sub>3</sub>)<sub>2</sub> (безводный); UO<sub>2</sub>(NO<sub>3</sub>)<sub>2</sub>·6H<sub>2</sub>O (кристаллогидрат). |
|||
Роль [[металл]]а в этой соли исполняет [[катион]] [[уранил]]а [UO<sub>2</sub>]<sup>2+</sup>. |
|||
<math>~\mathsf{4Ag + 4K_3[Fe(CN)_6] = 3K_4[Fe(CN)_6] + Ag_4[Fe(CN)_6]}</math> |
|||
== Физические свойства == |
|||
<math>~\mathsf{Ag_4[Fe(CN)_6] + UO_2(NO_3)_2 = 4AgNO_3 + (UO_2)_2[Fe(CN)_6]}</math> |
|||
Кристаллы жёлтого цвета с зеленоватым отблеском, легко растворимые в воде. Водный раствор имеет кислую реакцию. Также растворим в [[этанол]]е, [[ацетон]]е и [[Диэтиловый эфир|эфире]], нерастворим в [[бензол]]е, [[толуол]]е и [[хлороформ]]е. [[Молекулярный вес]] безводной формы 394,04; [[кристаллогидрат]]а 502,13. |
|||
== Химические свойства == |
|||
В 60-е годы XX века в [[СССР]] азотнокислый уранил свободно продавался в фотомагазинах{{Нет АИ|18|05|2009}}. |
|||
При нагревании кристаллы плавятся и выделяют [[Азотная кислота|азотную кислоту]] и воду. Кристаллогидрат легко выветривается на воздухе. |
|||
Характерная реакция — при действии [[аммиак]]а образуется жёлтый осадок урановокислого [[Аммоний|аммония]]: |
|||
== Литература == |
|||
* К. И. Мархилевич, В. А. Яштолд-Говорко. Фотографическая химия. М., Искусство, 1956. |
|||
: <math>\mathsf{2UO_2(NO_3)_2 + 6NH_3*H_2O \xrightarrow{} (NH_4)_2U_2O_7\downarrow + 4NH_4NO_3 + 3H_2O}</math> |
|||
<!-- |
|||
http://www.xumuk.ru/spravochnik/1513.html |
|||
Здесь свойства дигидрата(ди?) уранила |
|||
Обладает свойством [[дубление|дубить]] [[желатин]]. Ядовит. |
|||
http://www.d-76.ru/goods.php?id=182&MS1_MSS=ade6b30e8d92f1df35a5be7c93ccc3a3 |
|||
а эти продают по 69 рублей за грамм(?) |
|||
--> |
|||
== Получение == |
|||
{{Нитраты}} |
|||
Получают растворением [[Триоксид урана|трехокиси урана]] в [[Азотная кислота|азотной кислоте]]{{sfn|Карякин|1974|с=366}}: |
|||
{{уран}} |
|||
: <math>\mathsf{UO_3 + 2HNO_3 \ \xrightarrow{} \ UO_2(NO_3)_2 + H_2O}</math> |
|||
== Применение == |
|||
{{inorganic-compound-stub}} |
|||
В [[Фотография|фотографии]] на основе солей [[Серебро|серебра]] применяется как усилитель [[Негатив (фотография)|негативов]] и для тонирования готовых отпечатков (рецепт на основе азотнокислого уранила окрашивает фотоснимок в красно-коричневые тона). При этом часть серебра в изображении заменяется на железосинеродистый уранил (UO<sub>2</sub>)<sub>2</sub>[Fe(CN)<sub>6</sub>]. |
|||
Реакции протекают по уравнениям: |
|||
: <math>\mathsf{4Ag + 4K_3[Fe(CN)_6] \xrightarrow{} 3K_4[Fe(CN)_6] + Ag_4[Fe(CN)_6]}</math> |
|||
: <math>\mathsf{Ag_4[Fe(CN)_6] + 2UO_2(NO_3)_2 \xrightarrow{} 4AgNO_3 + (UO_2)_2[Fe(CN)_6]}</math> |
|||
Азотнокислый уранил входит в состав промышленно выпускаемых усилителей, применяемых в фотопечати, в частности, ОРВО 604. |
|||
== Примечания == |
|||
{{Примечания}} |
|||
== Литература == |
|||
* {{книга|автор = Волгин А. Г.|заглавие = Фотография. 1000 рецептов|место = М.|издательство = Химия|год = 1993}} |
|||
* {{книга|автор = Карякин Ю. В., Ангелов И. И.|заглавие = Чистые химические вещества|место = М.|издательство = Химия|год = 1974|страниц = 408|ref=Карякин}} |
|||
* {{книга|автор = Мархилевич К. И. , Яштолд-Говорко В. А.|заглавие = Фотографическая химия|место = М.|издательство = Искусство|год = 1956}} |
|||
{{Внешние ссылки}} |
|||
[[Категория:Соединения урана]] |
|||
{{Соединения урана}} |
|||
{{Фотографические реактивы}} |
|||
[[Категория:Соединения уранила]] |
|||
[[cs:Dusičnan uranylu]] |
|||
[[Категория:Нитраты|уранила]] |
|||
[[de:Uranylnitrat]] |
|||
[[Категория:Соединения азота по алфавиту]] |
|||
[[en:Uranyl nitrate]] |
|||
[[Категория:Фотографические реактивы]] |
|||
[[fa:اورانیل نیترات]] |
|||
[[fr:Nitrate d'uranyle]] |
|||
[[it:Nitrato di uranile]] |
|||
[[ja:硝酸ウラニル(VI)]] |
|||
[[pl:Azotan uranylu]] |
|||
[[zh:硝酸铀酰]] |
|||
Текущая версия от 07:12, 5 мая 2023
| Нитрат уранила | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Уранила нитрат |
| Традиционные названия | Азотнокислый уранил |
| Хим. формула | UO8N2 |
| Рац. формула | UO2(NO3)2 |
| Физические свойства | |
| Состояние | твёрдое, кристаллическое |
| Молярная масса | 394,04(безводн.); 502,13(гексагидрат) г/моль |
| Плотность | 3,35 г/см3 (дигидрат) |
| Термические свойства | |
| Температура | |
| • разложения | 100°C |
| Энтальпия | |
| • образования | 1987 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде, 20°C | 119 г/100 мл |
| • в воде, 30°C | 138 г/100 мл |
| • в ацетоне | растворим |
| • в этаноле | растворим |
| Классификация | |
| Рег. номер CAS | 10102-06-4 |
| PubChem | 24933 и 25199613 |
| Рег. номер EINECS | 233-266-3 |
| SMILES | |
| InChI | |
| Безопасность | |
| Токсичность | Высокотоксичен, радиоактивен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Урани́л азотноки́слый — неорганическое соединение, азотнокислая окись урана. Имеет формулу UO2(NO3)2 (безводный); UO2(NO3)2·6H2O (кристаллогидрат).
Роль металла в этой соли исполняет катион уранила [UO2]2+.
Физические свойства
[править | править код]Кристаллы жёлтого цвета с зеленоватым отблеском, легко растворимые в воде. Водный раствор имеет кислую реакцию. Также растворим в этаноле, ацетоне и эфире, нерастворим в бензоле, толуоле и хлороформе. Молекулярный вес безводной формы 394,04; кристаллогидрата 502,13.
Химические свойства
[править | править код]При нагревании кристаллы плавятся и выделяют азотную кислоту и воду. Кристаллогидрат легко выветривается на воздухе.
Характерная реакция — при действии аммиака образуется жёлтый осадок урановокислого аммония:
Обладает свойством дубить желатин. Ядовит.
Получение
[править | править код]Получают растворением трехокиси урана в азотной кислоте[1]:
Применение
[править | править код]В фотографии на основе солей серебра применяется как усилитель негативов и для тонирования готовых отпечатков (рецепт на основе азотнокислого уранила окрашивает фотоснимок в красно-коричневые тона). При этом часть серебра в изображении заменяется на железосинеродистый уранил (UO2)2[Fe(CN)6].
Реакции протекают по уравнениям:
Азотнокислый уранил входит в состав промышленно выпускаемых усилителей, применяемых в фотопечати, в частности, ОРВО 604.
Примечания
[править | править код]- ↑ Карякин, 1974, с. 366.
Литература
[править | править код]- Волгин А. Г. Фотография. 1000 рецептов. — М.: Химия, 1993.
- Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974. — 408 с.
- Мархилевич К. И. , Яштолд-Говорко В. А. Фотографическая химия. — М.: Искусство, 1956.


![{\displaystyle {\mathsf {4Ag+4K_{3}[Fe(CN)_{6}]\xrightarrow {} 3K_{4}[Fe(CN)_{6}]+Ag_{4}[Fe(CN)_{6}]}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/72e16e475b45a4079b75c813697111c1593c9e96)
![{\displaystyle {\mathsf {Ag_{4}[Fe(CN)_{6}]+2UO_{2}(NO_{3})_{2}\xrightarrow {} 4AgNO_{3}+(UO_{2})_{2}[Fe(CN)_{6}]}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/298497f5389307dc1deea0fc1b7bd59572c3dce4)