Карбонат натрия: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Нет описания правки Метки: через визуальный редактор с мобильного устройства из мобильной версии |
РобоСтася (обсуждение | вклад) м выпрямление ссылок, replaced: |заглавие=Химическая энциклопедия → |заглавие=Химическая энциклопедия, removed: |ссылка=https://ru.wikipedia.org/wiki/%D0%A5%D0%B8 |
||
| Строка 38: | Строка 38: | ||
В промышленности в основном получают из [[Хлорид натрия|хлорида натрия]] по аммиачно-хлоридному способу (метод Сольве){{переход|Метод Сольве}}. Технический карбонат натрия выпускается в виде '''кальцинированной соды''', содержащей от 87,0 до 99,4 % {{химическая формула|Na|2|C|1|O|3|sort=no}}{{переход|Сода кальцинированная}}. |
В промышленности в основном получают из [[Хлорид натрия|хлорида натрия]] по аммиачно-хлоридному способу (метод Сольве){{переход|Метод Сольве}}. Технический карбонат натрия выпускается в виде '''кальцинированной соды''', содержащей от 87,0 до 99,4 % {{химическая формула|Na|2|C|1|O|3|sort=no}}{{переход|Сода кальцинированная}}. |
||
Применяют при изготовлении [[Стекло|стекла]]{{переход|Стекло}}, для производства [[Моющее средство|моющих средств]], используют в процессе получения [[Алюминий|алюминия]] из [[ |
Применяют при изготовлении [[Стекло|стекла]]{{переход|Стекло}}, для производства [[Моющее средство|моющих средств]], используют в процессе получения [[Алюминий|алюминия]] из [[боксит]]ов, в качестве [[Нейтрализация|нейтрализующего]] агента при очистке [[Нефтепродукты|нефтепродуктов]]{{переход|Нефть}}, а также в пищевой промышленности{{переход|Пища}}<ref name="ХЭ_3_182" />. |
||
== Этимология == |
== Этимология == |
||
| Строка 44: | Строка 44: | ||
== Свойства == |
== Свойства == |
||
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 |
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C переходит в β-модификацию, также имеющую моноклинную кристаллическую решетку. Твёрдость по шкале Мооса моногидрата карбоната натрия составляет 1,3<ref name=pphoic>{{cite book|last = Pradyot|first = Patnaik|year = 2003|title = Handbook of Inorganic Chemicals|publisher = The McGraw-Hill Companies, Inc.|isbn = 978-0-07-049439-8|page = 861}}</ref>. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием [[Оксид натрия|оксида натрия]] и [[Диоксид углерода|диоксида углерода]]{{sfn|Рукк|1992}}{{sfn|Аликберова|2013}}. |
||
=== Кристаллогидраты{{якорь|Кристаллогидраты}} === |
=== Кристаллогидраты{{якорь|Кристаллогидраты}} === |
||
| Строка 51: | Строка 51: | ||
* гептагидрат карбоната натрия (минеральная форма неизвестна), Na<sub>2</sub>CO<sub>3</sub>·7H<sub>2</sub>O; |
* гептагидрат карбоната натрия (минеральная форма неизвестна), Na<sub>2</sub>CO<sub>3</sub>·7H<sub>2</sub>O; |
||
* моногидрат карбоната натрия ('''[[термонатрит]]'''), Na<sub>2</sub>CO<sub>3</sub>·H<sub>2</sub>O. |
* моногидрат карбоната натрия ('''[[термонатрит]]'''), Na<sub>2</sub>CO<sub>3</sub>·H<sub>2</sub>O. |
||
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na<sub>2</sub>CO<sub>3</sub>·10H<sub>2</sub>O, при 32,017 |
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na<sub>2</sub>CO<sub>3</sub>·10H<sub>2</sub>O, при 32,017 °C переходит в бесцветный ромбический Na<sub>2</sub>CO<sub>3</sub>·7H<sub>2</sub>O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na<sub>2</sub>CO<sub>3</sub>·H<sub>2</sub>O. В интервале 100−120 °C моногидрат теряет вод с образованием безводного карбоната натрия. |
||
''Декагидрат'' образуется из водных растворов, кристаллизующихся в диапазоне температур от −2,1 до +32,0 |
''Декагидрат'' образуется из водных растворов, кристаллизующихся в диапазоне температур от −2,1 до +32,0 °C, гептагидрата в узком диапазоне от 32,0 до 35,4 °C, а выше этой температуры образуется ''моногидрат''<ref>{{Cite journal|author=T. W. Richards and A. H. Fiske|year=1914|title=On the transition temperatures of the transition temperatures of the hydrates of sodium carbonate as fix points in thermometry|url=https://zenodo.org/record/1428987|url-status=live|journal=Journal of the American Chemical Society|volume=36|issue=3|pages=485–490|doi=10.1021/ja02180a003|archive-url=https://web.archive.org/web/20200614122641/https://zenodo.org/record/1428987|archive-date=2020-06-14|access-date=2021-10-22}}</ref>. |
||
Сообщалось о других гидратах, например, с 2,5 единицами воды на единицу карбоната натрия («пентагемигидрат»)<ref>{{cite web|url=http://www.minsocam.org/ammin/am15/am15_69.pdf|title=On the hydrates of sodium carbonate|author=A. Pabst|archive-url=https://web.archive.org/web/20211103135833/http://www.minsocam.org/ammin/am15/am15_69.pdf|archive-date=2021-11-03|access-date=2021-10-22|deadlink=no}}</ref>. |
Сообщалось о других гидратах, например, с 2,5 единицами воды на единицу карбоната натрия («пентагемигидрат»)<ref>{{cite web|url=http://www.minsocam.org/ammin/am15/am15_69.pdf|title=On the hydrates of sodium carbonate|author=A. Pabst|archive-url=https://web.archive.org/web/20211103135833/http://www.minsocam.org/ammin/am15/am15_69.pdf|archive-date=2021-11-03|access-date=2021-10-22|deadlink=no}}</ref>. |
||
| Строка 63: | Строка 63: | ||
|[[молекулярная масса]]||105,99 [[атомная единица массы|а. е. м.]]||286,14 а. е. м. |
|[[молекулярная масса]]||105,99 [[атомная единица массы|а. е. м.]]||286,14 а. е. м. |
||
|- |
|- |
||
|[[температура плавления]]||854 |
|[[температура плавления]]||854 °C||32 °C |
||
|- |
|- |
||
|[[растворимость]]||не растворим в [[ацетон]]е и [[сероуглерод]]е; малорастворим в [[этанол]]е; хорошо растворим в [[глицерин]]е и [[вода|воде]]|| |
|[[растворимость]]||не растворим в [[ацетон]]е и [[сероуглерод]]е; малорастворим в [[этанол]]е; хорошо растворим в [[глицерин]]е и [[вода|воде]]|| |
||
|- |
|- |
||
|[[плотность]] <math>\rho</math>||2,53 г/см³ (при 20 |
|[[плотность]] <math>\rho</math>||2,53 г/см³ (при 20 °C)||1,446 г/см³ (при 17 °C) |
||
|- |
|- |
||
|[[стандартная энтальпия образования]] ΔH||−1131 кДж/моль (т) (при 297 К)||−4083,5 кДж/моль ((т) (при 297К) |
|[[стандартная энтальпия образования]] ΔH||−1131 кДж/моль (т) (при 297 К)||−4083,5 кДж/моль ((т) (при 297К) |
||
| Строка 125: | Строка 125: | ||
=== Способ Леблана === |
=== Способ Леблана === |
||
В 1791 году французский химик [[Леблан, Никола|Николя Леблан]] получил патент на «Способ превращения [[Глауберова соль|глауберовой соли]] в соду». По этому способу смесь [[сульфат натрия|сульфата натрия]] («глауберовой соли»), [[Мел (материал)|мела]] или известняка ([[карбонат кальция|карбоната кальция]]) и [[древесный уголь|древесного угля]] запекается при температуре около 1000 |
В 1791 году французский химик [[Леблан, Никола|Николя Леблан]] получил патент на «Способ превращения [[Глауберова соль|глауберовой соли]] в соду». По этому способу смесь [[сульфат натрия|сульфата натрия]] («глауберовой соли»), [[Мел (материал)|мела]] или известняка ([[карбонат кальция|карбоната кальция]]) и [[древесный уголь|древесного угля]] запекается при температуре около 1000 °C. Уголь<ref name=Ullmann>{{cite encyclopedia|author=Christian Thieme|encyclopedia=Ullmann's Encyclopedia of Industrial Chemistry|publisher=Wiley-VCH|location=Weinheim|year=2000|doi=10.1002/14356007.a24_299|isbn = 978-3527306732|chapter = Sodium Carbonates}}</ref> восстанавливает сульфат натрия до сульфида: |
||
:: <math>\mathsf{Na_2SO_4 + 2C \rightarrow Na_2S + 2CO_2}</math> |
:: <math>\mathsf{Na_2SO_4 + 2C \rightarrow Na_2S + 2CO_2}</math> |
||
| Строка 151: | Строка 151: | ||
:: <math>\mathsf{NH_3 + CO_2 + H_2O + NaCl \rightarrow NaHCO_3 + NH_4Cl}</math> |
:: <math>\mathsf{NH_3 + CO_2 + H_2O + NaCl \rightarrow NaHCO_3 + NH_4Cl}</math> |
||
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 |
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия [[Фильтрование|отфильтровывают]] и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия: |
||
:: <math>\mathsf{2NaHCO_3 \xrightarrow[]{^ot} Na_2CO_3 + H_2O +CO_2\uparrow}</math> |
:: <math>\mathsf{2NaHCO_3 \xrightarrow[]{^ot} Na_2CO_3 + H_2O +CO_2\uparrow}</math> |
||
| Строка 184: | Строка 184: | ||
=== В пищевой промышленности === |
=== В пищевой промышленности === |
||
В пищевой промышленности карбонаты натрия зарегистрированы в качестве [[Пищевая добавка|пищевой добавки]] '''[[Список пищевых добавок E500-E599|E500]]''', — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na<sub>2</sub>CO<sub>3</sub>) имеет код 500i, [[гидрокарбонат натрия]] (пищевая сода, NaHCO<sub>3</sub>) — 500ii, их смесь — 500iii. |
В пищевой промышленности карбонаты натрия зарегистрированы в качестве [[Пищевая добавка|пищевой добавки]] '''[[Список пищевых добавок E500-E599|E500]]''', — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na<sub>2</sub>CO<sub>3</sub>) имеет код 500i, [[гидрокарбонат натрия]] (пищевая сода, NaHCO<sub>3</sub>) — 500ii, их смесь — 500iii. |
||
=== В нефтедобыче{{якорь|Нефть}} === |
=== В нефтедобыче{{якорь|Нефть}} === |
||
| Строка 190: | Строка 190: | ||
=== Производство стекла{{якорь|Стекло}} === |
=== Производство стекла{{якорь|Стекло}} === |
||
Карбонат натрия используют в [[Стекло|стекольном]] производстве. Карбонат натрия служит флюсом для кремнезема, понижая температуру плавления диоксида кремния от +2500 |
Карбонат натрия используют в [[Стекло|стекольном]] производстве. Карбонат натрия служит флюсом для кремнезема, понижая температуру плавления диоксида кремния от +2500 °C до +500 °C. Получавшееся стекло слабо растворимо в воде, поэтому в расплавленную смесь добавляют ещё ~10 % [[Карбонат кальция|карбоната кальция]], чтобы сделать стекло нерастворимым. |
||
[[Файл:Skansen, Stockholm, Sweden (Unsplash).jpg|thumb|right|{{center|Стеклодувная мастерская}}]] |
[[Файл:Skansen, Stockholm, Sweden (Unsplash).jpg|thumb|right|{{center|Стеклодувная мастерская}}]] |
||
| Строка 225: | Строка 225: | ||
== Литература == |
== Литература == |
||
* {{публикация|книга|заглавие=Химическая энциклопедия |
* {{публикация|книга|заглавие=[[Химическая энциклопедия]]|год=1992|ref=Химическая Энциклопедия|язык=ru|томов=5|ответственный=под ред. И. Л. Кнунянца|место=М.|издательство=Большая Российская энциклопедия|том=3|страниц=639|isbn=5-85270-039-8}} |
||
* {{книга|автор=Гурлев Д. С|заглавие=Справочник по фотографии (обработка фотоматериалов)|издательство=Тэхника|место=К.|год=1988|ref=Гурлев}} |
* {{книга|автор=Гурлев Д. С|заглавие=Справочник по фотографии (обработка фотоматериалов)|издательство=Тэхника|место=К.|год=1988|ref=Гурлев}} |
||
* {{ХЭ | автор = Рукк Н. С. | заглавие = Натрия карбонат | том = 3 | с= 182 | ref = Рукк}} |
* {{ХЭ | автор = Рукк Н. С. | заглавие = Натрия карбонат | том = 3 | с= 182 | ref = Рукк}} |
||
Текущая версия от 12:33, 13 сентября 2024
| Карбонат натрия | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий; декагидрат — стиральная сода | ||
| Хим. формула | Na2CO3 | ||
| Физические свойства | |||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Энтальпия | |||
| • образования | -1130,7 кДж/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 и 516885 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E500(i) и E500 | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| Безопасность | |||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
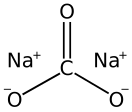
Карбона́т на́трия, углеки́слый на́трий, арх. кальцинированная сода Na2CO3 — средняя соль натрия и угольной кислоты. Бесцветные кристаллы или белый порошок, гигроскопична, хорошо растворима в воде. Растворы имеют сильнощелочную реакцию. Образует три основных кристаллогидрата — декагидрат Na2CO3·10H2O, гептагидрат Na2CO3·7H2O и моногидрат Na2CO3·H2O[1].
В промышленности в основном получают из хлорида натрия по аммиачно-хлоридному способу (метод Сольве). Технический карбонат натрия выпускается в виде кальцинированной соды, содержащей от 87,0 до 99,4 % Na2CO3.
Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов, в качестве нейтрализующего агента при очистке нефтепродуктов, а также в пищевой промышленности[1].
Этимология
[править | править код]«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии[2]. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из кристаллогидрата последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Свойства
[править | править код]Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C переходит в β-модификацию, также имеющую моноклинную кристаллическую решетку. Твёрдость по шкале Мооса моногидрата карбоната натрия составляет 1,3[3]. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода[4][5].
Кристаллогидраты
[править | править код]Карбонат натрия можно выделить в виде трех различных гидратов:
- декагидрат карбоната натрия (натрон), Na2CO3·10H2O;
- гептагидрат карбоната натрия (минеральная форма неизвестна), Na2CO3·7H2O;
- моногидрат карбоната натрия (термонатрит), Na2CO3·H2O.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100−120 °C моногидрат теряет вод с образованием безводного карбоната натрия.
Декагидрат образуется из водных растворов, кристаллизующихся в диапазоне температур от −2,1 до +32,0 °C, гептагидрата в узком диапазоне от 32,0 до 35,4 °C, а выше этой температуры образуется моногидрат[6].
Сообщалось о других гидратах, например, с 2,5 единицами воды на единицу карбоната натрия («пентагемигидрат»)[7].
| параметр | безводный карбонат натрия | декагидрат Na2CO3·10H2O |
|---|---|---|
| молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| температура плавления | 854 °C | 32 °C |
| растворимость | не растворим в ацетоне и сероуглероде; малорастворим в этаноле; хорошо растворим в глицерине и воде | |
| плотность | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297К) |
| стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297К) |
| стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297К) | |
| стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297К) |
| температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
Гидролиз
[править | править код]В водном растворе карбонат натрия гидролизуется, что обуславливает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Взаимодействие с кислотами
[править | править код]Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Нахождение в природе
[править | править код]В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные минеральные содовые озёра[англ.] известны в Забайкалье[8] и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии[9][неавторитетный источник]. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода добывается 4 компаниями в Вайоминге и одной в Калифорнии, около половины экспортируется[10]. Около четверти используемой в мире соды добывается из природных источников, 90 % из них добывается в США[11].
Получение
[править | править код]До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Барилла и водоросли
[править | править код]Некоторые виды растений-галофитов и морских водорослей могут быть переработаны для получения неочищенной формы карбоната натрия. Этот промышленный источник получения кальцинированной соды преобладал в Европе и других странах до начала 19 века.
Наземные растения (обычно англ. saltwort) или водоросли (обычно виды фукусов) собирали, сушили и сжигали. Затем золу «выщелачивали» (промывали водой) с образованием щелочного раствора. Этот раствор кипятили до сухого остатка, чтобы создать конечный продукт, который назвался «кальцинированной содой»; это очень старое название происходит от арабского слова «Soda», которое, в свою очередь, применяется к «соляной соде» — одному из многих видов прибрежных растений, собираемых для выращивания. «Барилла» — это коммерческий термин, применяемый к технической форме карбоната натрия, полученной из золы прибрежных растений или водорослей[12][13].
Концентрация карбоната натрия в кальцинированной соде варьировалась в очень широких пределах: от 2—3 % для формы, полученной из морских водорослей («ламинария»), до 30 % для лучшей бариллы, полученной из растений солянки (англ. saltwort) в Испании. Источники кальцинированной соды, а также связанная с ней щелочь «поташ» из растений и морских водорослей, к концу 18 века становились все более дорогостоящими источниками, и начался поиск более коммерчески обоснованных методов получения кальцинированной соды из поваренной соли и других распространённых химических реагентов.
Из нефелиновой руды
[править | править код]Российские ученые разработали процесс получения глинозема из нефелинового концентрата, особенностью которого является отсутствие побочных продуктов[14]. В процессе переработки из нефелинов и известняка получают цемент, кальцинированную соду, поташ и глинозем. Производится спекание нефелина с известняком, и продукт обрабатывается с целью извлечения оксида алюминия, кальцинированной соды и оксида калия. Затем, после выщелачивания, белитовый шлам используется для производства цемента[14].
В качестве полезного ископаемого
[править | править код]Трона, минерал, дигидрат тринатрийгидрогендикарбоната (Na3HCO3CO3·2H2O) добывается в Турции. Разработкой богатейшего месторождения троны в Бейпазары возле Анкары занимается компания Eti Soda[англ.], входящая в состав группы Ciner Holding[англ.]. Два миллиона тонн кальцинированной соды добыты в месторождении возле Анкары.
Его также добывают в некоторых щелочных озёрах, таких как озеро Магади в Кении дноуглубительными работами. Горячие солевые источники постоянно пополняют запас соли в озере, поэтому при условии, что скорость дноуглубительных работ не превышает скорость восполнения, источник является полностью возобновляемым.
Также добывается в нескольких районах США и обеспечивает почти все внутреннее потребление страны в карбонате натрия. Крупные природные месторождения, обнаруженные в 1938 году, — месторождение возле Грин-Ривер, штат Вайоминг, сделали разработку троны в качестве полезных ископаемых более экономичной, чем промышленное производство в Северной Америке.
Способ Леблана
[править | править код]В 1791 году французский химик Николя Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля запекается при температуре около 1000 °C. Уголь[15] восстанавливает сульфат натрия до сульфида:
Сульфид натрия далее реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород частично улавливался водой с получением соляной кислоты, но сама соляная кислота оставалась основным источником загрязнения воздуха.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х[16][17].
Промышленный аммиачный способ (способ Сольве)
[править | править код]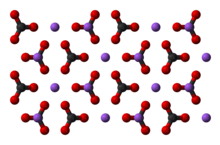
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день[18].
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2, полученный NH3 также возвращают в производственный цикл:
.Таким образом, единственным побочным продуктом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году[19]. Его производительность составляла 20 тысяч тонн соды в год.
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
[править | править код]Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
[править | править код]По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан в то время, когда отсутствовали промышленные методы получения аммиака, поэтому его было необходимо регенерировать из NH4Cl . Метод Хоу появился позже, когда аммиак производился по процессу Габера, поэтому необходимость регенерации аммиака уже не стояла так остро, а получаемый побочно NH4Cl возможно стало использовать как азотное удобрение.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу, как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[20].
Сода кальцинированная
[править | править код]Сода кальцинированная — технический карбонат натрия, выпускают в виде марки А (гранулированная) и марки Б (порошкообразная) по ГОСТ 5100-85[21] с содержанием Na2CO3 от 99,0 до 99,4 %, а также и из нефелиновой руды (ГОСТ 10689-75[22]) с содержанием Na2CO3 от 87,0 до 96,5 %. Гигроскопичный продукт, на воздухе поглощает водяной пар и углекислоту с образованием кислой соли гидрокарбоната натрия, слеживается при хранении на открытом воздухе[14].
Применение
[править | править код]Карбонат натрия применяют в мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный реагент для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[23]. В фотографии используется в составе проявителей как ускоряющее средство[24].
В пищевой промышленности
[править | править код]В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
В нефтедобыче
[править | править код]Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
Производство стекла
[править | править код]Карбонат натрия используют в стекольном производстве. Карбонат натрия служит флюсом для кремнезема, понижая температуру плавления диоксида кремния от +2500 °C до +500 °C. Получавшееся стекло слабо растворимо в воде, поэтому в расплавленную смесь добавляют ещё ~10 % карбоната кальция, чтобы сделать стекло нерастворимым.

Стекло для бутылок и окон (натриево-известковое стекло) изготавливается путем плавления таких смесей карбоната натрия, карбоната кальция и кварцевого песка (диоксида кремния (SiO2)). При нагреве компонентов смеси происходит разложение карбонатов на оксиды металлов (Na2O и CaO) и диоксид углерода (CO2). Таким образом, карбонат натрия традиционно является источником оксида натрия. Натриевое стекло на протяжении веков было самой распространенной формой стекла[15].
Снижение жесткости воды
[править | править код]Карбонат натрия применяется для смягчения воды паровых котлов и уменьшения жёсткости воды. Жесткая вода содержит растворенные соединения, обычно соединения кальция или магния. Карбонат натрия используется для снятия временной и постоянной жесткости воды.[25]
Карбонат натрия является водорастворимым источником карбонат-ионов для катионов магния Mg2+ и кальция Ca2+. Эти ионы образуют нерастворимые твердые осадки при обработке карбонат-ионами:
Сходным образом реагируют катионы магния:
.
Вода смягчается, поскольку в ней уменьшается концентрация ионов кальция и магния.[25]
Безопасность
[править | править код]Предельно допустимая концентрация аэрозоля кальцинированной соды в воздухе производственных помещений — 2 мг/м3[4]. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии — дерматит.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
Примечания
[править | править код]- ↑ 1 2 Химическая Энциклопедия, 1992, Т. 3, с. 182—183.
- ↑ «Soda»: An etymological «headache»? Дата обращения: 6 февраля 2019. Архивировано 7 февраля 2019 года.
- ↑ Pradyot, Patnaik. Handbook of Inorganic Chemicals. — The McGraw-Hill Companies, Inc., 2003. — P. 861. — ISBN 978-0-07-049439-8.
- ↑ 1 2 Рукк, 1992.
- ↑ Аликберова, 2013.
- ↑ T. W. Richards and A. H. Fiske (1914). "On the transition temperatures of the transition temperatures of the hydrates of sodium carbonate as fix points in thermometry". Journal of the American Chemical Society. 36 (3): 485—490. doi:10.1021/ja02180a003. Архивировано 14 июня 2020. Дата обращения: 22 октября 2021.
- ↑ A. Pabst. On the hydrates of sodium carbonate. Дата обращения: 22 октября 2021. Архивировано 3 ноября 2021 года.
- ↑ Б. Б. Намсараев, Д. Д. Бархутова. Содовые озёра Южного Забайкалья-уникальные экосистемы // Вестник Бурятского Государственного Университета:Биология.География : журнал. — 2018. — № 1. — С. 82—86. — doi:10.18101/2587-7143-2018-1-82-86. Архивировано 12 ноября 2021 года.
- ↑ Юрий Константинов. Лечение содой. Народные рецепты. Архивировано 3 февраля 2019 года. — Litres 2019 isbn 5040325053
- ↑ Soda Ash Statistics and Information (USGS). Архивировано 13 ноября 2021 года. — 2020 mineral commodity summary. Архивировано 13 июля 2020 года.
- ↑ Lazenby, Henry US soda ash producers aim to capture more market share with cleaner footprint (англ.). Mining Weekly (26 июня 2014). Дата обращения: 22 августа 2020. Архивировано 20 ноября 2017 года.
- ↑ Барилла // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Hooper, Robert. Lexicon Medicum. — 1848. — London : Longman, 1802. — P. 1198–9.
- ↑ 1 2 3 Михаил Коломиец, Любовь Михайлова. Рынок кальцинированной соды: состояние и прогнозы // The Chemical Journal : журнал. — 2005. — Ноябрь. — С. 28—32. Архивировано 23 января 2022 года.
- ↑ 1 2 Christian Thieme (2000). "Sodium Carbonates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 978-3527306732.
- ↑ Clow, Archibald and Clow, Nan L. (1952). Chemical Revolution, (Ayer Co Pub, June 1952), pp. 65-90. ISBN 0-8369-1909-2.
- ↑ Kiefer, David M. (January 2002). "It was all about alkali". Today's Chemist at Work. 11 (1): 45—6. Архивировано 4 апреля 2019. Дата обращения: 22 октября 2021.
- ↑ Global soda ash industry — emerging dynamics — Blogs — Televisory
- ↑ История создания и развития Березниковского содового завод. Архивировано 19 августа 2019 года., Государственный архив Пермской области, 1997
- ↑ WebCite query result. Дата обращения: 1 марта 2008. Архивировано из оригинала 7 апреля 2008 года.
- ↑ ГОСТ 5100-85 Сода кальцинированная техническая. Технические условия
- ↑ Межгосударственный стандарт ГОСТ 10689-75 "Сода кальцинированная техническая из нефелинового сырья. Технические условия" (утв. постановлением Госстандарта СССР от 3 декабря 1975 г. N 4100)
- ↑ Патент на изобретение. Дата обращения: 6 октября 2013. Архивировано из оригинала 8 июля 2014 года.
- ↑ Гурлев, 1988, с. 298.
- ↑ 1 2 Архивированная копия. Дата обращения: 22 октября 2021. Архивировано 7 июля 2021 года.
Литература
[править | править код]- Химическая энциклопедия : [рус.] : в 5 т. / под ред. И. Л. Кнунянца. — М. : Большая Российская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Рукк Н. С. Натрия карбонат // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 182. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
Ссылки
[править | править код]- НА́ТРИЯ КАРБОНА́Т : [арх. 6 сентября 2022] / Аликберова Л. Ю. // Нанонаука — Николай Кавасила. — М. : Большая российская энциклопедия, 2013. — С. 130. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 22). — ISBN 978-5-85270-358-3.
- ГОСТ 5100-85 Сода кальцинированная техническая. Технические условия (с Изменением N 1). Государственный комитет СССР по стандартам. Дата обращения: 11 апреля 2019.
- ГОСТ 83-79 Натрий углекислый Технические условия. Государственный комитет СССР по стандартам. Дата обращения: 29 декабря 2021.









![{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/5908963ccad7f278ec1e97ff1fbc8ece58a9096d)



