Оксимы
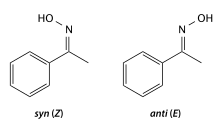
Оксимы (или изонитрозосоединения) — органические соединения, включающие в себя одну или несколько изонитрозогрупп RR1C=N-OH. Обычно рассматриваются как производные альдегидов (R1 = H) - альдоксимы и кетонов - кетоксимы[1]. Для альдоксимов и оксимов несимметричных кетонов характерна цис — транс изомерия по связи C=N.
Физические свойства
Оксимы обычно легкоплавкие твердые вещества, в чистом виде - белого цвета. Плохо растворяются в воде, хорошо в органических растворителях. Цис- и транс- изомеры различаются по физическим свойствам (темпертура плавления, спектры), взаимопревращение стереоизомеров происходит при действии кислот или облучении светом.
В ИК-области в спектрах оксимов наблюдаются слабые полосы валентных колебаний связей O–H при 3650-3500 см−1 и C=N при 1690-1650 см−1; валентные колебания N-O обуславливают сильную полосу поглощения при 960-930 см−1.
Методы синтеза
Наиболее распространенным лабораторным методом синтеза оксимов является реакции альдегидов и кетонов с гидроксиламином:
- CH3COCH3 + NH2OH CH3(C=N-OH)CH3 + H2O
Другим широко используемым методом является изомеризация нитрозосоединений, содержащих водород в α-положении к нитрозогруппе:
Такая изомеризация проходит in situ при нитрозировании некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой:
- PhCOCH3 + C5H11ONO [ PhCOCH2N=O ] PhCOCH=N-OH
Оксимы также могут быть синтезированы окислением первичных аминов:
- RR1CH-NH2 + H2O2 RR1C=NOH + H2O
либо восстановлением нитросоединений:
- RCH2NO2 + [H] RCH=NOH + H2O
Реакционная способность

Оксимы проявляют амфотерные свойства, являясь как очень слабыми основаниями, так и слабыми кислотами (pKa ~ 11, pKb ~ 12).
Оксимы под действием алкоголятов щелочных металлов оксимы депротонируются, образуя соответствующие соли, они также могут образовывать соли с переходными металлами, в последнем случае возможно комплексообразование, особенно в случае бидентантных оксимов. Так, например, диметилглиоксим (реактив Чугаева) образует с двухвалентным никелем прочный нерастворимый комплекс; эта реакция используется для гравиметрического определения никеля.
Оксимы являются амбидентантными нуклеофилами, способными алкилироваться и по атому кислорода, и по атому азота: так, соли оксимов с щелочными металлами алкилируются алкилгалогенидами с образованием O-алкилоксимов:
- RR1C=NOH + C2H5ONa RR1C=NONa + C2H5OH
- RR1C=NONa + R2I RR1C=NOR2 + NaI
Алкилирование может идти и по атому азота, в этом случае образуются нитроны, к образованию нитронов ведет также присоединение к оксимам присоединение α,β-ненасыщенных карбонильных соединений[2]:
Энергичными восстановителями оксимы восстанавливаются до аминов, также возможно восстановление до N-замещенных гидроксиламинов.
Оксимы дегидрируются с образованием иминоксильных радикалов:
- R2C=NOH R2C=N-O.
Под действием перокситрифторуксусной кислоты, получаемой in situ из трифторуксусного ангидрида и перекиси водорода оксимы окисляются до нитросоединений; в случае циклогексаноноксима реакцию проводят в кипящем ацетонитриле в присутствии буфера, при окислении оксимов α-дикетонов в α-нитрокарбонильные соединения в качестве растворителя может быть использован хлороформ или трифторуксусная кислота, необходимости в буфере в этом случае нет, предполагается, что первоначально образуется аци-форма нитросоединения, которая затем таутомеризуется:
- RCOCR=NOH + CF3COOOH RCOCR=NO(OH) RCOCHRNO2
N-бромсукцинимид (NBS) реагирует с оксимами с образованием соответствующего гем-бромнитрозопроизводного:
- R2C=NOH + NBS R2CBr(NO)
Под действием азотной кислоты оксимы дают гем-нитронитрозосоединения:
- R2C=NOH + HNO3 R2CNO(NO2)
Под действием кислотных и ацилирующих агентов (PCl5, P2O5, полифосфорные кислоты, хлорангидриды сульфокислот и карбоновых кислот) альдоксимы отщепляют воду с образованием нитрилов:
- RCH=NOH + Ac2O RCN + 2 AcOH
Кетоксимы в таких условиях перегруппировываются в амиды (Перегруппировка Бекмана), перегруппировка стереоспецифична - к азоту мигрирует радикал, находящийся в транс-положении к гидроксилу:
- RR1CH=NOH RCONHR1
Перегруппировка Бекмана циклогексаноноксима является промышленным методом синтеза капролактама - мономера капрона (найлона-6):
Перегруппировку Бекмана также претерпевают O-замещённые кетоксимы (сложные эфиры оксимов, перегруппировка Бекмана-Чепмена):
- RR1CH=NOR2 RCONR1R2
α-Гидроксикетоксимы в условиях перегруппировки Бекмана расщепляются с образованием альдегида и нитрила (расщепление по Бекману или перегруппировка Вернера):
- RCH(OH)CR1=NOH RCHO + R1CN + H2O
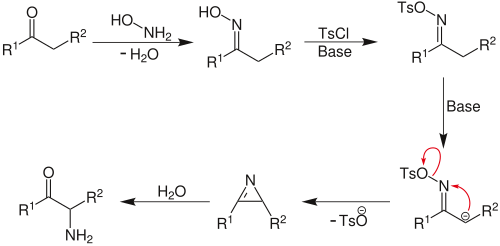
O-сульфонаты оксимов алифатических кетонов под действием оснований претерпевают перегруппировку, образуя азирины, гидролизующиеся далее до α-аминокетонов (перегруппировка Небера), эта реакция является синтетическим методом α-аминирования кетонов[3]:
Применение
Некоторые оксимы (аллоксим, диэтиксим, дипироксим, изонитрозин) являются реактиваторами холинэстеразы и используются в качестве антидотов при отравлениях фосфорорганическими инсектицидами.
Оксим циклогексанона является крупнотоннажным продуктом, используемым в производстве капролактама.
Диметилглиоксим используется в аналитической химии для обнаружения и количественного определения никеля («реактив Чугаева»), никелевый комплекс этого вещества (диметилглиоксимат никеля) используется в качестве красного пигмента.
Примечания
- ↑ oximes // IUPAC Gold Book
- ↑
Nakama, Kimitaka (2001). "A new synthetic access to N-alkylated nitrones through Lewis acid-catalyzed conjugate additions of aldoximes". Tetrahedron Letters. 42 (38): 6719–6722. doi:16/S0040-4039(01)01346-6. ISSN 0040-4039. Дата обращения: 13 августа 2011.
{{cite journal}}: Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка); Проверьте значение|doi=(справка) - ↑ P. W. Neber, A. v. Friedolsheim: Über eine neue Art der Umlagerung von Oximen. In: Liebigs Ann. 1926, 449. 109–134.
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |