Реакция Хека
Реакция Хека — катализируемое комплексами палладия сочетание алкил- и арилгалогенидов с алкенами, содержащими при двойной связи хотя бы один атом водорода. Реакция была открыта американским химиком Ричардом Хеком в 1968 году. Ошибочно используемое название «реакция Мизороки — Хека» возникло из-за многочисленных ссылок на работу 1971 года под авторством японского химика Т. Мизороки, где он также описывает данную реакцию, и работу Хека, датированную 1972 годом, хотя первооткрывателем Хек стал четырьмя годами раньше[1]. Изначально реакция была открыта как сочетание арилртутных соединений с алкенами в присутствии солей палладия, однако в середине 1980-х годов появился каталитический вариант и удобные методы проведения этой реакции[2].
В настоящее время реакция формально представляет собой замещение атома водорода при двойной связи на алкильный или арильный остаток в составе галогенида с обращением конфигурации двойной связи[3].

Механизм
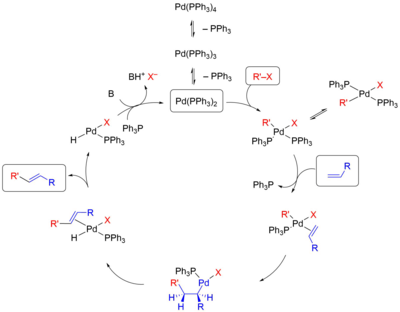
На первой стадии реакции происходит окислительное присоединение галогенида к ненасыщенному атому палладия с образованием алкил(арил)палладиевого интермедиата. Затем происходит координация и внедрение молекулы алкена по связи C-Pd. При этом степень окисления палладия возрастает от 0 до +2. Наконец, на третьей стадии происходит β-элиминирование с образованием продукта реакции, после чего под действием основания происходит регенерация катализатора[4].
Генерирование катализатора
Активная каталитическая частица — дифосфиновый комплекс Pd(PPh3)2 — образуется из тетракис(трифенилфосфин)палладия Pd(PPh3)4 в результате диссоциации двух лигандов[4]. Иногда катализатор генерируют путём восстановления какого-либо комплекса Pd(II): обычно такое восстановление происходит при действии самого фосфинового лиганда и содействии присутствующих в смеси нуклеофилов (гидроксидов, алкоксидов, воды или др.). В отсутствие фосфина роль восстановителя выполняют амин, если он используется как основание, или алкен, восстанавливающий катализатор по механизму типа Вакер-процесса. Проблемой на данной стадии является недостаточно высокая концентрация дифосфинового комплекса в реакционной смеси, которая уменьшается с увеличением концентрации свободного лиганда, а также его склонность к диспропорционированию на трифосфиновый лиганд и неустойчивые низкокоординированные комплексы, быстро агрегирующие в неактивные металлические частицы[5].
Окислительное присоединение
Окислительное присоединение является типичным процессом в металоорганической химии в данном случае подчиняется общим зависимостям. Скорость этой стадии зависит главным образом от природы группы X и увеличивается в следующем ряду[4]:
В большинстве случаев в результате присоединения галогенида к комплексу образуется выделяемый транс-продукт, в котором группы R' и X расположены друг напротив друга. Однако было показано, что в действительности проиходит образование цис-продукта, который затем претерпевает цис/транс-изомеризацию. Более того, именно цис-комплекс участвует в следующей стадии[6].
Внедрение
Для координации алкена с комплексом палладия необходимо, чтобы один из лигандов покинул координационную сферу металла. Для этого процесса предложено два механизма, которые различаются в зависимости от того, заряженный или незаряженный лиганд уходит из комплекса: в нейтральном механизме это делает, как правило, фосфин, а в катионном, или заряженном, механизме комплекс покидает анион X–. Выбор пути зависит от природы лигандов, присутствующих в комплексе. Для монодентатных фосфиновых лигандов вероятно протекание реакции как по нейтральному пути, так и по катионному[6].
На стадии внедрения задаётся региоселективность реакции Хека, которая определяется пространственными и электронными факторами. Для нейтрального и катионного типа реакции с участием алкенов, обогащённых электронами, решающими являются электронные факторы: палладий присоединяется к атому углерода, имеющему бо́льшую электронную плотность. Электронные факторы легко перекрываются пространственными: новая C-C-связь создаётся у менее замещённого атома углерода двойной связи. Именно этот критерий является решающим во внутримолекулярной реакции Хека[7].
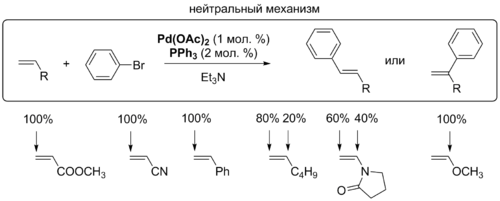
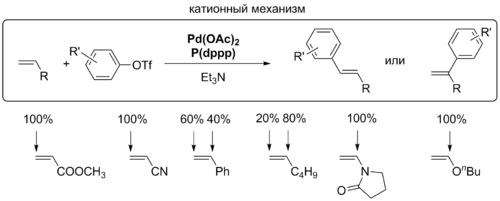
β-Элиминирование
На стадии β-элиминирования происходит выведение продукта из сферы реакции и образование гидридного комплекса палладия. Поскольку данная стадия совершается из наиболее устойчивой конформации, образуется продукт E-конфигурации. Процесс протекает как син-элиминирование (то есть атомы палладия и водорода отщепляются по одну сторону молекулы субстрата)[8]. Обратимость стадии β-элиминирования приводит к частичной изомеризации алкена. Её можно избежать путём использования соли серебра в качестве основания[9][1].
Условия реакции
Типичные условия реакции Хека предусматривают использование 1—5 мол. % палладиевого катализатора вместе с фосфиновыми лигандами и подходящего основания (растворимого, как триэтиламин, или нерастворимого, как карбонат калия, карбонат серебра). В случае активных галогенидов (иодидов) необходимая концентрация катализатора крайне мала и может быть снижена до миллионных долей. Лигандами могут выступать триарилфосфины, N-ацилзамещённые дипиридилы, N-ацилзамещённые дипиримидиламины, лиганд Пфальтца и лиганды, основанные на кетопиновой кислоте[1].
Известно, что ускорить реакцию и понизить температуру её проведения можно при использовании комбинации катализатора межфазного переноса и гетерогенного основания[1].
Кроме галогенидов в реакцию сочетания с алкенами могут вступать арилсиланы, станнаны, трифлаты, соединения висмута и сурьмы, соли диазония и др.[1]
Ограничения
В реакции Хека нельзя использовать галогениды, содержащие атомы водорода в β-положении, поскольку они подвергаются β-элиминированию[1].
Примечания
- ↑ 1 2 3 4 5 6 CONRR, 2010.
- ↑ Смит, Дильман, 2009, с. 111.
- ↑ Смит, Дильман, 2009, с. 112.
- ↑ 1 2 3 Смит, Дильман, 2009, с. 112—113.
- ↑ Beletskaya, Cheprakov, 2000, p. 3011—3012.
- ↑ 1 2 Beletskaya, Cheprakov, 2000, p. 3012.
- ↑ Beletskaya, Cheprakov, 2000, p. 3015.
- ↑ Beletskaya, Cheprakov, 2000, p. 3017.
- ↑ Смит, Дильман, 2009, с. 113.
Литература
- Русскоязычные источники
- Смит В. А., Дильман А. Д. Глава 5.3. Реакция Хека // Основы современного органического синтеза. — М.: Бином. Лаборатория знаний, 2009. — С. 111—117. — ISBN 978-5-94774-941-0.
- Обзорные статьи
- Beletskaya I. P., Cheprakov A. V. The Heck Reaction as a Sharpening Stone of Palladium Catalysis (англ.) // Chem. Rev. — 2000. — Vol. 100, no. 8. — P. 3009—3066. — doi:10.1021/cr9903048. — PMID 11749313. Архивировано 20 декабря 2024 года.
- Heck Reaction // Comprehensive Organic Name Reactions and Reagents. — Wiley, 2010. — doi:10.1002/9780470638859.conrr301.
- Оригинальные работы
- Heck R. F., Nolley Jr. J. P. Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides (англ.) // J. Org. Chem. — 1972. — Vol. 37, no. 14. — P. 2320—2322. — doi:10.1021/jo00979a024.
- Mizoroki T., Mori K., Ozaki A. Arylation of Olefin with Aryl Iodide Catalyzed by Palladium (англ.) // Bull. Chem. Soc. Jap.. — 1971. — Vol. 44. — P. 581. — doi:10.1246/bcsj.44.581.

