Реакция Хека
Реакция Хека — катализируемое комплексами палладия сочетание алкил- и арилгалогенидов с алкенами, содержащими при двойной связи хотя бы один атом водорода. Реакция была открыта американским химиком Ричардом Хеком в 1968 году. Ошибочно используемое название «реакция Мизороки — Хека» возникло из-за многочисленных ссылок на работу 1971 года под авторством японского химика Т. Мизороки, где он также описывает данную реакцию, и работу Хека, датированную 1972 годом, хотя первооткрывателем Хек стал четырьмя годами раньше[1]. Изначально реакция была открыта как сочетание арилртутных соединений с алкенами в присутствии солей палладия, однако в середине 1980-х годов появился каталитический вариант и удобные методы проведения этой реакции[2].
В настоящее время реакция формально представляет собой замещение атома водорода при двойной связи на алкильный или арильный остаток в составе галогенида с обращением конфигурации двойной связи[3].

Механизм
[править | править код]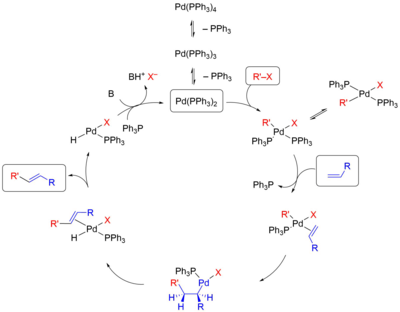
На первой стадии реакции происходит окислительное присоединение галогенида к ненасыщенному атому палладия с образованием алкил(арил)палладиевого интермедиата. Затем происходит координация и внедрение молекулы алкена по связи C-Pd. При этом степень окисления палладия возрастает от 0 до +2. Наконец, на третьей стадии происходит β-элиминирование с образованием продукта реакции, после чего под действием основания происходит регенерация катализатора[4].
Генерирование катализатора
[править | править код]Активная каталитическая частица — дифосфиновый комплекс Pd(PPh3)2 — образуется из тетракис(трифенилфосфин)палладия Pd(PPh3)4 в результате диссоциации двух лигандов[4]. Иногда катализатор генерируют путём восстановления какого-либо комплекса Pd(II): обычно такое восстановление происходит при действии самого фосфинового лиганда и содействии присутствующих в смеси нуклеофилов (гидроксидов, алкоксидов, воды или др.). В отсутствие фосфина роль восстановителя выполняют амин, если он используется как основание, или алкен, восстанавливающий катализатор по механизму типа Вакер-процесса. Проблемой на данной стадии является недостаточно высокая концентрация дифосфинового комплекса в реакционной смеси, которая уменьшается с увеличением концентрации свободного лиганда, а также его склонность к диспропорционированию на трифосфиновый лиганд и неустойчивые низкокоординированные комплексы, быстро агрегирующие в неактивные металлические частицы[5].
Окислительное присоединение
[править | править код]Окислительное присоединение является типичным процессом в металлоорганической химии в данном случае подчиняется общим зависимостям. Скорость этой стадии зависит главным образом от природы группы X и увеличивается в следующем ряду[4]:
В большинстве случаев в результате присоединения галогенида к комплексу образуется выделяемый транс-продукт, в котором группы R' и X расположены друг напротив друга. Однако было показано, что в действительности происходит образование цис-продукта, который затем претерпевает цис/транс-изомеризацию. Более того, именно цис-комплекс участвует в следующей стадии[6]. Во многих случаях данная стадия определяет скорость всего процесса[7].
Внедрение
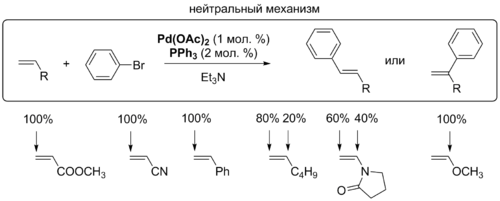
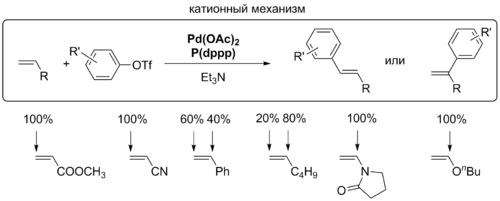
[править | править код]Для координации алкена с комплексом палладия необходимо, чтобы один из лигандов покинул координационную сферу металла. Для этого процесса предложено два механизма, которые различаются в зависимости от того, заряженный или незаряженный лиганд уходит из комплекса: в нейтральном механизме это делает, как правило, фосфин, а в катионном, или заряженном, механизме комплекс покидает анион X-. Выбор пути зависит от природы лигандов, присутствующих в комплексе. Для монодентатных фосфиновых лигандов вероятно протекание реакции как по нейтральному пути, так и по катионному[6].
На стадии внедрения задаётся региоселективность реакции Хека, которая определяется пространственными и электронными факторами. Для нейтрального и катионного типа реакции с участием алкенов, обогащённых электронами, решающими являются электронные факторы: палладий присоединяется к атому углерода, имеющему бо́льшую электронную плотность. Электронные факторы легко перекрываются пространственными: новая C-C-связь создаётся у менее замещённого атома углерода двойной связи. Именно этот критерий является решающим во внутримолекулярной реакции Хека[8].
β-Элиминирование
[править | править код]На стадии β-элиминирования происходит выведение продукта из сферы реакции и образование гидридного комплекса палладия. Данная стадия совершается после смены конформации комплекса на более устойчивую, и образуется продукт E-конфигурации. Процесс протекает как син-элиминирование (то есть атомы палладия и водорода отщепляются по одну сторону молекулы субстрата)[9]. Обратимость стадии β-элиминирования приводит к частичной изомеризации алкена. Её можно избежать путём использования соли серебра в качестве основания[10][1].
Условия реакции
[править | править код]Субстраты
[править | править код]Диазониевые соли
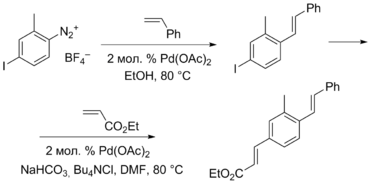
[править | править код]Типичными субстратами, сочетающимися с алкенами, в реакции Хека являются галогениды, а также трифлаты. Кроме них найдены также другие электрофилы, вступающие в сочетание и позволяющие проводить его в более мягких условиях. В качестве первой альтернативы были испытаны соли диазония, в частности, тетрафторбораты. Реакция с диазониевыми солями протекает в отсутствие основания и фосфинов, добавка которых приводит к разложению соли. При этом, видимо, роль основания выполняет спирт, используемый в качестве растворителя. Использование диазониевых солей ускоряет реакцию, но также требует использования большего количества катализатора (не менее 1—2 %), восстановление которого происходит за счёт распада соли диазония. При этом соль не обязательно вводить в реакцию в чистой форме: она может быть получена по реакции диазотирования одновременно с протеканием реакции Хека. Бо́льшая активность диазогруппы по сравнению с йодидом была использована в ступенчатой сборке сложных молекул[11].
Иодониевые соли
[править | править код]Аналогичными реагентами являются иодониевые соли, проявляющие реакционную способность, подобную диазониевым солям, но имеющие бо́льшую устойчивость к основаниям. Высокая скорость реакции и низкие температуры позволяют использовать данную модификацию в трудных ситуациях, когда из-за жёстких условий невозможно применить классическую реакцию Хека. В то же время соли иодония не так доступны, поэтому их применение в простых случаях неоправданно[12].
Иодониевые соли содержат два арильных или винильных заместителя при атоме иода, и при обычных условиях к алкену переносится лишь один заместитель, тогда как при 100 °С в реакции участвуют обе группы. Для того чтобы избежать потери порой ценного заместителя, были предложены иодониевые соли с одним «ненужным» заместителем, роль которого обычно выполняет фенильная группа. Если в несимметричной соли присутствуют винильная и арильная группа, то в реакции участвует винильная. Из двух арильных групп более активной является та, которая содержит электронодонорные группы (несмотря на то, что обычно для окислительного присоединения арилгалогенидов зависимость обратная). Описаны также реакции циклических иодониевых солей[12].
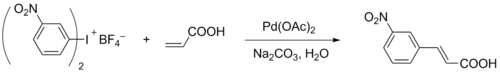
Хлорангидриды и ангидриды
[править | править код]Хлорангидриды были предложены в качестве альтернативных субстратов достаточно рано. Реакция с их участием включает стадию декарбонилирования, после которой она протекает в соответствии с каталитическим циклом реакции Хека. Декарбонилирование является и самым требовательным этапом реакции, поскольку для его протекания в комплексе должно присутствовать три свободных координационных места, и любой лиганд с хорошим связыванием ингибирует реакцию. Поэтому реакцию лучше проводить в неполярных растворителях, в присутствии объёмных аминов, не способных к координации, и в отсутствие фосфинов. Аналогичная реакция с участием ангидридов примечательна тем, что для её проведения не требуется добавление основания, поскольку выделяющийся в реакции карбоксилат-ион сам способен выступать как основание. Это явление особенно ценно в тех случаях, когда требуется максимально упростить состав реакционной смеси[13].

Катализаторы
[править | править код]Типичные условия реакции Хека предусматривают использование 1—5 мол. % палладиевого катализатора вместе с фосфиновыми лигандами и подходящего основания (растворимого, как триэтиламин, или нерастворимого, как карбонат калия, карбонат серебра). В случае активных галогенидов (иодидов) необходимая концентрация катализатора крайне мала и может быть снижена до миллионных долей. Лигандами могут выступать триарилфосфины, N-ацилзамещённые дипиридилы, N-ацилзамещённые дипиримидиламины, лиганд Пфальтца и лиганды, основанные на кетопиновой кислоте[1]. Бидентатные фосфины считались плохими лигандами для реакции Хека, однако они хорошо проявили себя в катионном механизме и стали использоваться в энантиоселективном варианте реакции, где важен точный контроль координационной сферы комплекса. При этом вместо хлоридов необходимо использовать трифторметансульфонаты (трифлаты) и добавлять в реакционную смесь соли серебра или таллия, что не добавляет методу привлекательности. Тем не менее хелатирующие фосфиновые лиганды имеют и положительные стороны: нет необходимости использовать их избыток для получения стабильного каталитического комплекса, сами комплексы более устойчивы при хранении, они обладают большим числом оборотов и могут быть использованы повторно[14].

Открытие Херрманом (нем. Herrmann) каталитической активности комплекса Pd2(P(o-Tol)3)2(μ-OAc)2 стало значимой вехой в развитии реакции Хека. Этот катализатор стал называться его именем и получил краткое обозначение hc. Он представляет собой одну из наиболее удобных форм палладиевого катализатора, легко синтезируется по реакции ацетата палладия и соответствующего фосфина, устойчив к воздуху и влаге. Главное его преимущество заключается в том, что он является аналогом монофосфинового комплекса палладия, который крайне трудно получить как из мультифосфиновых лигандов, так и из смеси предшественника с фосфином. В то же время монофосфиновые комплексы весьма активны и в то же время более устойчивы, чем бесфосфиновые комплексы. Палладацикл Херрмана является наиболее изученным катализатором такого типа. Он весьма активно катализирует сочетания арилбромидов (ацетат натрия, диметилформамид, 100—140 °С), особенно содержащих акцепторные группы. В этих случаях число оборотов катализатора достигает 106[15].
Ещё одним видом палладиевых катализаторов для реакции Хека являются комплексы с N-гетероциклическими карбенами[16].
Отдельной задачей является создание катализаторов, которые можно легко регенерировать и повторно использовать после реакции. В случае реакции Хека эта задача достаточно сложна, поскольку в ней участвует множество компонентов, состав смеси постоянно меняется, каталитическая система нестабильна и может отравляться солями, образующимися в результате реакции основания с выделяющимся эквивалентом кислоты. Число оборотов катализаторов как функция от времени реакции резко падает после небольшого периода активности. Тем не менее работы по поиску регенерируемых катализаторов ведутся, поскольку реакция Хека представляет значительный промышленный интерес. Основной идеей таких разработок является создание гетерогенных систем, в которых продукты и катализаторы будут находиться в разных фазах. Разработаны двухфазные системы с двумя жидкими фазами и с жидкой и твёрдой фазами. В последнем подходе палладиевый катализатор иммобилизовали на полимерах, содержащих фосфиновые лиганды, и различных неорганических подложках (силикагеле, цеолитах и др.)[17].
В качестве катализаторов могут применяться и более дешёвые аналоги. Большие перспективы связаны с никелем. В частности, показано, что никель может катализировать реакцию Хека при использовании стехиометрического количества восстановителя (например, цинковой пыли). Очевидно, никелевый катализатор не регенерируется столь же эффективно, как палладий. Однако никель имеет одно серьёзное преимущество: он позволяет использовать в реакции алифатические галогениды. Описаны также примеры использования солей меди, платины, родия, иридия и рутения[18].
Межфазные переносчики
[править | править код]
Роль межфазного переносчика выполняют четвертичные аммониевые соли. Они могут быть переносчиками между твёрдой и жидкой фазами, если в реакции используются основания, практически нерастворимые в типичных для реакции Хека растворителях (ацетаты, карбонаты, гидрокарбонаты, фосфаты натрия или калия). Также они могут осуществлять перенос между жидкими фазами в случае, если основание растворимо в воде, а субстрат нет. Галогениды, ацетат и другие ионы ускоряют реакцию, увеличивая плотность заряда на атоме палладия и облегчая стадию окислительного присоединения (это относится не только к аммониевым солям, но и к солям металлов). Четвертичные аммониевые соли могут также стабилизировать низкокоординированные палладиевые комплексы или вступать в ионный обмен, например, замещать иод на хлор в комплексе в реакциях арилиодидов. Путём такой замены галогенового лиганда происходит «переключение» с нейтрального механизма на заряженный[19].
Известно также, что использование четвертичных аммониевых солей позволяет ускорить реакцию и понизить температуру её проведения. Так, реакции арилиодидов можно проводить при температуре ниже 100 °С и даже при комнатной температуре. По этой причине добавление соли-промотора стало популярным приёмом при проведении реакции Хека[19].
Растворители
[править | править код]Для реакции Хека подходят многие растворители, но наиболее часто применяют диполярные апротонные растворители (диметилформамид, N-метилпирролидон, диметилсульфоксид и ацетонитрил), поскольку они обладают способностью стабилизировать комплексы палладия за счёт слабой координации. Также оказалось, что для реакции можно использовать воду. Она может выступать как лиганд в палладиевом комплексе, вытесняя другие, менее сильно связанные лиганды, например, иодид, который отравляет катализатор и блокирует заряженный механизм реакции. Однако вода может вытеснять и полезные лиганды, например, ацетат или гидрокарбонат. Вода способствует созданию более компактных переходных состояний за счёт гидрофобных взаимодействий. Это влияет на скорость реакции и её селективность, особенно в случае внутримолекулярной реакции Хека[20].
В качестве среды в реакции Хека можно использовать ионные жидкости, представляющие собой жидкие при комнатной температуре соли, или расплавы солей. Они имеют высокую полярность и направляют реакцию по заряженному механизму, а также стабилизируют низкокоординированные комплексы палладия. Наиболее простым и рекомендуемым примером такого растворителя является бромид тетрабутиламмония[21].
Кроме галогенидов в реакцию сочетания с алкенами могут вступать арилсиланы, станнаны, трифлаты, соединения висмута и сурьмы, соли диазония, соединения гипервалентного иода и др.[7][1]
Промышленное значение
[править | править код]По состоянию на 2001 год, реакция Хека использовалась для промышленного синтеза ряда важных продуктов в количестве более 1 тонны в год. Среди них гербицид просульфурон, получаемый по реакции 2-сульфонатобензолдиазония с 3,3,3-трифторпропеном, и солнцезащитное средство 2-этилгексил-п-метоксициннамат. Противовоспалительный препарат напроксен получают по реакции Хека между 2-бром-6-метоксинафталином и этиленом и последующей реакцией карбонилирования. Реакция Хека совместима со многими функциональными группами, что позволяет её использовать на последних стадиях синтеза сложных соединений. Так, она являлась ключевой стадией в синтезе противоастматического препарата сингуляра. Мягкие условия реакции позволили использовать её для сочетания неустойчивых ароматических бромидов для получения мономеров покрытий компонентов электроники[22].

Примечания
[править | править код]- ↑ 1 2 3 4 CONRR, 2010.
- ↑ Смит, Дильман, 2009, с. 111.
- ↑ Смит, Дильман, 2009, с. 112.
- ↑ 1 2 3 Смит, Дильман, 2009, с. 112—113.
- ↑ Beletskaya, Cheprakov, 2000, p. 3011—3012.
- ↑ 1 2 Beletskaya, Cheprakov, 2000, p. 3012.
- ↑ 1 2 de Meijere, Meyer, 1995, p. 2381.
- ↑ Beletskaya, Cheprakov, 2000, p. 3015.
- ↑ Beletskaya, Cheprakov, 2000, p. 3017.
- ↑ Смит, Дильман, 2009, с. 113.
- ↑ Beletskaya, Cheprakov, 2000, p. 3050—3052.
- ↑ 1 2 Beletskaya, Cheprakov, 2000, p. 3052—3053.
- ↑ Beletskaya, Cheprakov, 2000, p. 3053—3054.
- ↑ Beletskaya, Cheprakov, 2000, p. 3020.
- ↑ Beletskaya, Cheprakov, 2000, p. 3024—3025.
- ↑ Beletskaya, Cheprakov, 2000, p. 3029—3030.
- ↑ Beletskaya, Cheprakov, 2000, p. 3046—3050.
- ↑ Beletskaya, Cheprakov, 2000, p. 3054—3055.
- ↑ 1 2 Beletskaya, Cheprakov, 2000, p. 3030—3032.
- ↑ Beletskaya, Cheprakov, 2000, p. 3038.
- ↑ Beletskaya, Cheprakov, 2000, p. 3041—3042.
- ↑ de Vries J. G. The Heck reaction in the production of fine chemicals (англ.) // Can. J. Chem. — 2001. — Vol. 79. — P. 1086–1092. — doi:10.1139/cjc-79-5/6-1086. Архивировано 21 мая 2013 года.
Литература
[править | править код]Русскоязычные источники
- Смит В. А., Дильман А. Д. Глава 5.3. Реакция Хека // Основы современного органического синтеза. — М.: Бином. Лаборатория знаний, 2009. — С. 111—117. — ISBN 978-5-94774-941-0.
Обзорные статьи
- Beletskaya I. P., Cheprakov A. V. The Heck Reaction as a Sharpening Stone of Palladium Catalysis (англ.) // Chem. Rev. — 2000. — Vol. 100, no. 8. — P. 3009—3066. — doi:10.1021/cr9903048. — PMID 11749313. Архивировано 19 августа 2013 года.
- de Meijere A., Meyer F. E. Fine Feathers Make Fine Birds: The Heck Reaction in Modern Garb (англ.) // Angew. Chem. Int. Ed. — 1995. — Vol. 33, no. 23—24. — P. 2379—2411. — doi:10.1002/anie.199423791.
- Heck Reaction // Comprehensive Organic Name Reactions and Reagents. — Wiley, 2010. — doi:10.1002/9780470638859.conrr301.
Оригинальные работы
- Heck R. F. Acylation, methylation, and carboxyalkylation of olefins by Group VIII metal derivatives (англ.) // J. Am. Chem. Soc. — 1968. — Vol. 90, no. 20. — P. 5518—5526. — doi:10.1021/ja01022a034.
- Heck R. F. Mechanism of arylation and carbomethoxylation of olefins with organopalladium compounds (англ.) // J. Am. Chem. Soc. — 1969. — Vol. 91, no. 24. — P. 6707—6714. — doi:10.1021/ja01052a029.
- Mizoroki T., Mori K., Ozaki A. Arylation of Olefin with Aryl Iodide Catalyzed by Palladium (англ.) // Bull. Chem. Soc. Jap.. — 1971. — Vol. 44. — P. 581. — doi:10.1246/bcsj.44.581.
- Heck R. F., Nolley Jr. J. P. Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides (англ.) // J. Org. Chem. — 1972. — Vol. 37, no. 14. — P. 2320—2322. — doi:10.1021/jo00979a024.

