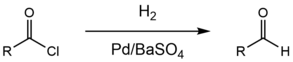Именные реакции в органической химии
В органической химии существует огромное число реакций, носящих имя исследователя, открывшего или исследовавшего данную реакцию. Часто в названии реакции фигурируют имена нескольких учёных: это могут быть авторы первой публикации (например, процесс Фишера — Тропша), первооткрыватель и исследователь реакции (реакция Бородина — Хунсдикера), учёные, одновременно опубликовавшие результаты о новой реакции.
В зависимости от традиции, название на разных языках может сильно отличаться. Например, одна и та же реакция известна как «реакция Бородина — Хунсдикера» в русскоязычной литературе, как «реакция Хунсдикера» (нем. Hunsdiecker-Reaktion) или «реакция Хунсдикера — Бородина» (Hunsdiecker-Borodin-Reaktion) в немецкоязычной литературе, и как «реакция Хунсдикера» (англ. Hunsdiecker reaction) — в англоязычной. Реакция превращения спиртов в алкилгалогениды с помощью трифенилфосфина и тетрагалогенида углерода, известная в немецкой литературе как «реакция Аппеля» (Appel-Reaktion), остаётся, как правило, безымянной в русскоязычной[источник не указан 2991 день]. Часто в названиях реакций предпочтение отдается учёным своей школы.
Ориентироваться среди таких названий сложно. Данная статья создана с целью облегчить поиск информации об основных именных реакциях в органической химии.
Реакция Аллана — Робинсона
англ. Allan–Robinson reaction
Синтез флавонов и изофлавонов из гидроксиарилкетонов и ангидридов карбоновых кислот:
Перегруппировка Амадори
англ. Amadori rearrangement
Обратимое превращение N-арилгликозиламинов в аминокетозы под действием кислот.
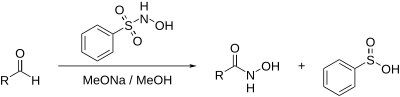
Реакция Анджели — Римини
англ. Angeli–Rimini reaction
Синтез гидроксамовых кислот из альдегидов:
англ. Henry reaction или Nitroaldol reaction
Конденсация альдегидов с нитросоединениями с образованием нитроспиртов под действием оснований:
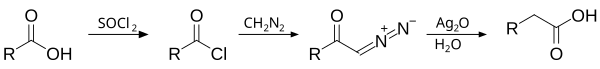
Реакция Арндта — Эйстерта
англ. Arndt–Eistert synthesis или Arndt–Eistert reaction
Превращение карбоновой кислоты в ближайший гомолог с использованием диазометана:
Открыта в 1935 году.
Реакция Аппеля
Синтез алкилхлоридов и алкилбромидов из спиртов при их взаимодействии с четырёххлористым либо четырёхбромистым углеродом и трифенилфосфином.
Реакция Ауверса
англ. Auwers synthesis или Auwers reaction
Превращение кумаранонов во флавонолы под действием спиртового раствора щелочи:
Открыта немецким химиком Ауверсом в 1908 году.
Окисление по Байеру — Виллигеру
англ. Baeyer–Villiger oxidation
Окисление альдегидов или кетонов пероксокислотами в карбоновые кислоты или сложные эфиры:
Открыта в 1899 году немецкими химиками Адольфом фон Байером и Виктором Виллигером.
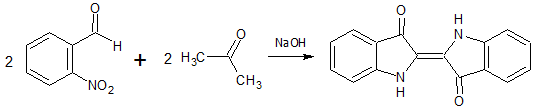
Синтез Байера — Древсена
англ. Baeyer–Drewson indigo synthesis
Синтез индиго посредством конденсации нитробензальдегида с ацетоном:
Перегруппировка Бамбергера
англ. Bamberger rearrangement
Превращение N-фенилгидроксиламина в 4-аминофенол под действием кислоты:
Открыта в 1894 году немецким химиком Бамбергером.
Реакция Барджеллини
англ. Bargellini reaction
Синтез морфолинонов и пиперазинонов из ацетона и аминопропанола или диаминопропана:
Декарбоксилирование Бартона
англ. Barton decarboxylation
Радикальное декарбоксилирование карбоновых кислот через соответствующие тиокарбонильные производные:
Реакция Бартона
англ. Barton reaction
Фотолиз нитритов — перегруппировка эфира спирта и азотистой кислоты в нитрозоспирт:
Реакция Белоусова — Жаботинского
англ. Belousov–Zhabotinsky reaction
Класс химических реакций, протекающих в колебательном режиме. Примером такого типа реакций служит реакция Реакция Бриггса — Раушера.
Реакция Бернтсена
англ. Bernthsen acridine synthesis
Метод синтеза 5-замещенных акридинов конденсацией диариламинов с карбоновыми кислотами или их производными в условиях кислотного катализа:
Реакция Бёрча
англ. Birch reduction
В 1944 году А. Бёрч открыл реакцию восстановления ароматического кольца раствором щелочного металла в жидком аммиаке в присутствии спирта в качестве протонирующего агента. Открытие этой реакции произошло из-за случайного попадания спирта в раствор натрия в жидком аммиаке.
Реакция Бородина — Хунсдикера
англ. Hunsdiecker reaction или Borodin–Hunsdiecker reaction
Реакция серебряных солей карбоновых кислот с галогенами, дающая в результате галогенозамещенные углеводороды.
Реакция Бриггса — Раушера
англ. Briggs-Rauscher reaction или Briggs–Rauscher oscillating reaction
Автоколебательная химическая реакция. При взаимодействии пероксида водорода, йодноватой кислоты, сульфата марганца(II), серной и малоновой кислот и крахмала возникает колебательная реакция с переходами бесцветный — золотой — синий.
Перегруппировка Брука
англ. Brook rearrangement
Изомеризация α-, β- и γ-силилсодержащих спиртов в силильные эфиры под действием основания.

Реакция Буво — Блана
англ. Bouveault-Blanc reduction
(ацилоиновая конденсация)
Образование α-гидроксикетонов (ацилоинов) при восстановлении сложных эфиров моно- и дикарбоновых алифатических кислот натрием в инертной атмосфере. Впервые реакцию наблюдали в 1903 году Л. Буво и Г. Блан.
Включает несколько стадий:
- Образование анион-радикала
- Образование аниона.
Конечным продуктом реакции является 1,2-кетон—ендиолят, который после протонирования превращается в α-оксикетон (ацилоин).
Эта реакция не находила применения в органической химии до тех пор, пока А. Штоль и В. Прелог в 1947 году не применили её для синтеза карбоциклических соединений со средним или большим размером цикла из диэфиров α,ω-дикарбоновой кислоты. Реакцию проводили в кипящем ксилоле при перемешивании с мелкодиспергированным натрием в токе аргона-для предотвращения окисления натрия и промежуточных анионов. В этом случае конденсация дает прекрасный выход.
Для повышения выхода реакции используют триметилхлорсилан (который подавляет конденсацию Дикмана), образующиеся при этом бис-триметилсилиловые эфиры ендиолов легко выделяются и при взаимодействии со спиртом образуют ацилоины. Это позволяет не только повысить выход, но и свести к минимуму побочные процессы.
Такая методика ацилоиновой конденсации стала общепринятой.
Реакция Бутлерова
англ. Butlerov reaction или Formose reaction
Автокаталитическая реакция синтеза различных сахаров из формальдегида в слабощелочных водных растворах в присутствии ионов металлов, например кальция.
Реакция Вильсмейера — Хаака
Один из способов введения карбонильной группы в ароматическое кольцо. Реакция состоит из двух стадий — образование реагента Вильсмейера — Хаака и его присоединения к кольцу. Реагент представляет собой слабый электрофил. Поэтому реакция лучше протекает с электронообогащенными карбо- и гетероциклами.

Реакция Виттига
англ. Wittig reaction
Реакция Виттига, открыта в 1954 году, остаётся лучшим современным методом региоспецифического синтеза алкенов со строго определённым положением двойной связи. Реакция заключается во взаимодействии альдегида или кетона с илидами фосфора, приводящая к образованию алкена и окиси фосфина.
(C6H5)3P + CH3Br → [(C6H5)3P-CH3]Br
[(C6H5)3P-CH3]Br + C6H5Li → (C6H5)3P-CH2: (радикал) + С6H6 + LiBr
CH3-CO-CH3 + (C6H5)3P-CH2: → CH3-C(CH3)=CH2 + (C6H5)3P=O
Реакция Вюрца
англ. Wurtz reaction или Wurtz coupling
Метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или иодиды).
Реакции Ганча
1. Синтез замещённых пиридинов конденсацией β-дикарбонильных соединений с альдегидами и аммиаком.
2. Синтез тиазолов конденсацией α-галогенкарбонильных соединений (альдегидов, кетонов, карбоновых кислот) или их производных (ацеталей) с тиоамидами.
3. Синтез пирролов циклоконденсацией α-галогенкетонов с аммиаком или аминами и β-дикарбонильными соединениями.
Реакция Глазера
англ. Glaser coupling
В присутствии солей ацетата меди(II) в присутствии пиридина алкины окисляются кислородом воздуха до диацетиленов:
4R-C≡C-H + O2 → 2R-C≡C-C≡C-R + 2H2O
См. также реакцию Ходкевича — Кадио
англ. Diels-Alder reaction
В 1928 году немецкие учёные О. Дильс и К. Альдер открыли реакцию 1,4-присоединения соединений с двойной связью к сопряжённому диену с образованием производного циклогексена.
Реакция Зандмейера
англ. Sandmeyer reaction
Замена диазониевой группы в ароматических солях диазония на заместитель в присутствии солей меди(I)
В 1884 году Т. Зандмейер[англ.] открыл реакцию, которая позволяла замещать диазогруппы на хлор-, бром- и циано-группу, катализируя солями Cu(I).
В общем виде реакция выглядит так:
Реакция Зелинского
Тримеризация ацетилена. Реакция происходит при пропускании ацетилена над активированным углем при температуре 400 °C. Используется для получения бензола.
Реакция Зинина
Метод получения ароматических аминов восстановлением нитросоединений
Реакция Канниццаро
англ. Cannizzaro reaction
Окислительно-восстановительная реакция ароматических альдегидов открыта в 1853 году итальянским химиком С. Канниццаро.
Реакция Кастро — Стефенса
англ. Castro–Stephens reaction
Синтез арилацетиленов (по аналогии с методом Ходкевича-Кадио):
C6H5-X + Cu-C≡CR → C6H5-C≡CR + CuX
C6H5-C≡C-X + Cu-C≡CR → C6H5-C≡C-C≡C-R + CuX
См. также реакцию Ходкевича-Кадио
Реакция полного восстановления кетогрупы с помощью гидразина и сильного основания (чаще всего — гидроксидом калия).

англ. Clemmensen reduction
Открыта в 1913 году. Реакция заключается в восстановлении карбонильной группы в ароматических и жирноароматических кетонах с помощью амальгированного цинка и соляной кислоты. позволяет получать алкилбензолы с первичной алкильной группой, недоступные по реакции Фриделя-Крафтса. Механизм детально не установлен.
Конденсация Кляйзена
англ. Claisen condensation
Химическая реакция присоединения-фрагментации, в которой принимают участие карбонильная и активированная метиленовая группы (в присутствии основания, отщепляющего протон от метиленовой).
Реакция Кнёвенагеля
Реакция Кнёвенагеля — конденсация альдегидов или кетонов с соединениями, содержащими активную метиленовую группу, в присутствии оснований с образованием производных этилена. Например, при конденсации бензойного альдегида (I) с диэтиловым эфиром малоновой кислоты (II) в присутствии пиперидина получается производное коричной кислоты (III):
С6H5CHO + CH2(COOC2H5)2 → C6H5CH=C(COOC2H5)2 + H2O
I II III
Конденсация Кнёвенагеля широко применяется в лабораторном органическом синтезе, а также в химико-фармацевтической и парфюмерной промышленностях. Реакция открыта немецким химиком Э. Кнёвенагелем (нем. E. Knoevenagel) в 1896 году.
Лит.: Серрей А. Справочник по органическим реакциям / Пер. с англ. — М., 1962.
Реакция Кольбе
Реакция Кольбе — реакция электролиза карбоновых кислот или их солей с получением углеводородов.
Реакция Кольбе — Шмидта
англ. Kolbe–Schmitt reaction или Kolbe process
Карбоксилирование фенолята натрия диоксидом углерода.
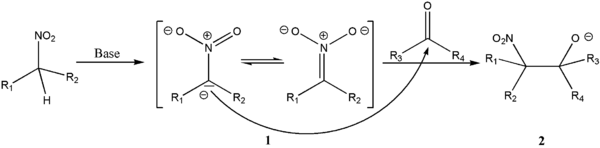
Реакция Коновалова
Нитрование алифатических, алициклических и жирноароматических соединений разбавленной НNО3.
Реакция Кори — Хауса
В разделе про эту реакцию: R — алкил, R' — алкил или арил, X — галоген.
Реакция Кори — Хауза заключается в получении нового алкана из галогенида или псевдогалогенида алкила и реактива Гилмана (соединения меди с алкилом или арилом) с помощью лития и иодида меди(I). Реакция протекает в три этапа:
1. Вначале реакцией замещения дегалогенируют органический радикал:
- .
2. На втором этапе получают реактив Гилмана комплесообразованием с помощью иодида меди(I):
- .
3. Собственно реакцией Кори — Хауса является реакция разрушения комплекса реактива Гилмана с помощью галогенида или псевдогалогенида арила или другого алкила и образования связи между этими органическими радикалами:
Важно, что если R и R' — не один и тот же радикал, то в весовых количествах будет получен только смешанный продукт R'R; RR и R'R' будет слишком мало.
Реакция Кори — Хауса является одной из самых ранних изученных реакций с таким активным взаимодействием металлов с органическими веществами при их синтезе[1].
Реакция Криге
англ. Criegee reaction
- Реакция окислительного расщепления β-гликолей тетраацетатом свинца с образованием карбонильных соединений.
- Реакция цис-гидроксилирования олефинов при помощи тетраоксида осмия OsO4.
- Термическая перегруппировка третичных пероксоэфиров с образованием карбонильных соединений.
Реакция Кулинковича
англ. Kulinkovich reaction
Синтез циклопропанолов при взаимодействии сложных эфиров с реагентами Гриньяра, содержащими атом водорода в β-положении, в присутствии тетраизопропоксида титана.

Реакция Кучерова
англ. Kucherov reaction
Реакция заключается в получении карбонильных соединений из алкинов в присутствии солей ртути (II) в кислой водной среде. При этом в процессе гидратации образуется енол, который изомеризуется (таутомеризуется) в альдегид или кетон.
англ. Mannich reaction
Открыта в 1912 году. Реакция является основным способом получения α-диалкиламинометилкетонов при конденсации кетонов с формальдегидом и гидрохлоридом вторичного амина.
Реакция Меншуткина
англ. Menshutkin reaction
Синтез четвертичных аммониевых солей из третичных аминов и органических галогенидов.
Реакция Михаэля
англ. Michael reaction или Michael addition
Нуклеофильное присоединение к ненасыщенным соединениям:
Обычно в реакцию вступают системы с электроноакцепторными заместителями (Z), например:
Реакция открыта в 1887 году.
Реакция Мицунобу
англ. Mitsunobu reaction
Специальный метод органической химии, в процессе которого, под действием трифенилфосфина и диэтилового эфира азодикарбоновой кислоты (C2H5O2CN=NCO2C2H5, DEAD) происходит превращение гидроксильной группы спиртов в различные функциональные группы.
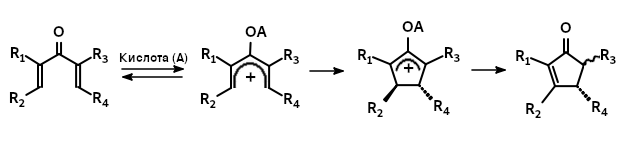
Реакция Назарова
Реакция циклизации дивинилкетонов в циклопентеноны под действием кислот Льюиса или Брёнстеда. Механизм этой реакции включает 4π-электроциклизацию пентадиенильных катионных интермедиатов.
Реакция Петрова — Кормера
Реакции ениновых и диениновых углеводородов и их функциональных производных(спиртов, эфиров, галогенидов) с литийорганическими соединениями алифатического, ароматического и элементоорганического рядов(амидов, фосфидов), приводящих к образованию широкого класса алленовых соединений.
Реакция Перкина
англ. Perkin reaction
Метод синтеза β-арилакриловых кислот (коричной кислоты, её производных и аналогов) взаимодействием ароматических альдегидов с ангидридами карбоновых кислот в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, третичных аминов и т. п.)
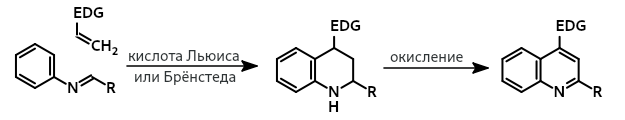
Реакция Поварова
англ. Povarov reaction
Трёхкомпонентная реакция ароматических аминов, альдегидов и алкенов (или алкинов), приводящая к образованию тетрагидрохинолинов или хинолинов. Формально является [4+2]-циклоприсоединением ароматических оснований Шиффа к электронообогащенным алкенам при катализе кислотами Льюиса или Брёнстеда.
Реакция Раймера-Тимана
англ. Reimer–Tiemann reaction
Орто-формилирование фенолов хлороформом в присутствии сильного основания.
Реакция Розенмунда — Зайцева
англ. Rosenmund reduction
Селективное каталитическое восстановление ацетилхлоридов водородом до альдегидов.
Реакция Стилле
англ. Stille reaction или Stille Coupling
Сочетание органического производного олова с sp2-гибридизованным органическим галлогенидом, катализируемая комплексами Pd(0).
Реакция Сузуки
англ. Suzuki coupling или Suzuki reaction
Химическая реакция сочетания арил- винил-бороновых кислот с арил- или винил-галлидами, катализируемая комплексами Pd(0).
Реакция Торпа
англ. Thorpe reaction
Самоконденсация нитрилов в условиях основного катализа, результатом которой является образование енаминов.
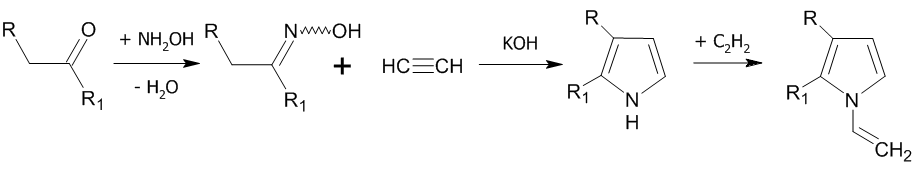
Реакция Трофимова
Взаимодействие ацетилена с оксимами кетонов в присутствии сильного основания приводит к получению пиррольного кольца:
Гетероциклизация протекает при температуре 70—120 °C в среде диметилсульфоксида.
Реакция Фаворского
1. Ацетилен-алленовая перегруппировка.
Катализируемая сильными основаниями перегруппировка алкинов в аллены и миграция двойной связи в углеродной цепи была открыта А. Е. Фаворским в 1888 году. Он получал бутин-1 дегидрогалогенированием 2,2-дихлорбутана под действием спиртового раствора КОН в ампуле при 170 °C. Неожиданно вместо бутина-1 был получен бутин-2.
CH3-CH2-C≡CH ↔ [CH3-CH=C=CH2] ↔ CH3-C≡C-CH3
2. Присоединение карбонильных соединений к алкинам.
В присутствии сильных оснований алкины с концевой тройной связью способны присоединять карбонильные соединения с образованием спиртов:
CH3-C≡CH + CH3-CO-CH3 → CH3-C≡C-C(OH)(CH3)2
3. конденсация алкинов со спиртами.
Реакция нуклеофильного присоединения спиртов к алкинам в присутствии щелочей с образованием алкенильных эфиров:
CH3-C≡CH + CH3CH2OH → CH3-C(OC2H5)=CH2
Реакция Фаворского — Реппе
англ. Reppe synthesis
В 1925 году Реппе разработал промышленный способ присоединения ацетилена к формальдегиду на основе реакции Фаворского. При высоком давлении, порядка 100 атм, в присутствии ацетиленида меди происходит присоединение ацетилена к формальдегиду с образованием двух важных продуктов — пропаргилового спирта и бутин-2-диола-1,4:
HC≡CH + CH2O → HC≡C-CH2OH
HC≡C-CH2OH + CH2O → HOCH2C≡C-CH2OH
Процесс Фишера — Тропша
англ. Fischer Tropsch synthesis
Химическая реакция, происходящая в присутствии катализатора, в которой монооксид углерода (CO) и водород (H2) преобразуются в различные жидкие углеводороды.
Реакция Фриделя — Крафтса
англ. Friedel–Crafts reaction
Способ алкилирования и ацилирования ароматических соединений в присутствии катализаторов кислотного характера, например AlCl3, BF3, ZnCl2, FeCI3, минеральных кислот, окислов, катионообменных смол. Алкилирующими агентами служат алкилгалогениды, олефины, спирты, сложные эфиры; ацилирующими — карбоновые кислоты, их галогенангидриды и ангидриды.
Реакция Хека
англ. Heck reaction или Mizoroki–Heck reaction
Сочетание ненасыщенных галогенидов (или трифлатов) с алкенами в присутствии сильных оснований и катализаторов на основе Pd(0)
Реакция Ходкевича — Кадио
англ. Cadio-Chodkiewicz reaction или Cadio–Chodkiewicz coupling
Эту реакцию иначе называют ацетиленовой конденсацией. Она заключается во взаимодействии ацетиленовых углеводородов с бром- или йодалкинами с образованием диацетиленов:
RC≡CH + Br-C≡CR' → RC≡C-C≡CR' + HBr
См. также реакцию Кастро — Стефенса.
Реакция Хорнера-Вадсворта-Эммонса
англ. Horner-Wadsworth-Emmons reaction
Модификация реакции Виттига, в которой вместо илидов фосфора используются фосфонаты.
Реакция Штаудингера
Получение иминофосфоранов реакцией фосфинов с азидами.
Примечания
- ↑ Информация взята из статьи на английской википедии «Corey—House synthesis»
Литература
- О. А. Реутов, А. Л. Курц, К. П. Бутин Органическая химия в 4-х частях, Изд.: «БИНОМ. Лаборатория знаний», М., 2004.
- Ли Дж. Дж. Именные реакции. Механизмы органических реакций, Изд.: «БИНОМ. Лаборатория знаний», М., 2006.
- Химическая энциклопедия в 5 томах, Изд.: «Советская энциклопедия», 1988.
- П. Сайкс, Механизмы реакций в органической химии, Изд.: «Химия», 1991.
- Начала химии. Современный курс для поступающих в вузы. Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. Изд. «Экзамен», 2006.
- Вацуро К.В., Мищенко Г. Л. Именные реакции в органической химии. — М.: «Химия», 1976. — 528 с. — 11 000 экз.
Русские источники по именным реакциям в органической химии
- http://www.khimia.ru/NameRus.htm Архивная копия от 12 сентября 2010 на Wayback Machine
- http://orgchemlab.com/name-reactions.html Архивная копия от 28 октября 2017 на Wayback Machine
- http://www.chemistry.org.ua/namedreactions/90 Архивная копия от 27 октября 2017 на Wayback Machine













![{\displaystyle {\mathsf {2RLi+CuI\rightarrow \ Li[R_{2}Cu]+LiI}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/66c07caeb48f83b10b7bf3017c764c6e6cc4cf30)
![{\displaystyle {\mathsf {Li[R_{2}Cu]+R'X\xrightarrow {\ } R'R+RCu+LiX}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/7277eeecb1ec20e2f6eb11f167a8a5265aa92c02)