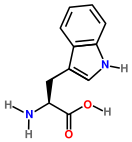
Триптофан
| Триптофан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
2-амино-3-(1H-индол-3-ил)пропионовая кислота | ||
| Сокращения |
Три, Trp, W UGG |
||
| Хим. формула | C11H12N2O2 | ||
| Рац. формула | C11H12N2O2 | ||
| Физические свойства | |||
| Молярная масса | 204,23 г/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,39[1] | ||
| Классификация | |||
| Рег. номер CAS | 73-22-3 | ||
| PubChem | 6305 и 6923516 | ||
| Рег. номер EINECS | 200-795-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16828 и 57912 | ||
| ChemSpider | 6066 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Триптофа́н (β-(β-индолил)-α-аминопропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах, L и D, и в виде рацемата (рацемической смеси) (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
История
[править | править код]Впервые в 1890 г. триптофан выделил из пищеварительного фермента трипсина и описал его свойства немецкий химик Рихард Ноймайстер и он же дал название аминокислоте. Греческий суффикс «фан» означает «указывающий на»[2].
Биосинтез
[править | править код]Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата, имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В реакции высвобождается неорганический пирофосфат (в присутствии пирофосфатазы реакция протекает практически необратимо). У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат, претерпевая перегруппировку Амадори, изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией, приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, происходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB)[3].
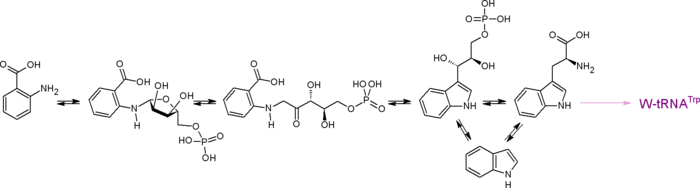
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
[править | править код]Этот раздел не завершён. |
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
[править | править код]
Триптофан является биологическим прекурсором серотонина[4] (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[5] и депрессии, но клинические испытания не дали окончательных результатов[6]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин, или 5-HT)[7].
В связи с преобразованием 5-HTP в серотонин в печени есть значительный риск появления пороков сердца из-за влияния серотонина на сердце[8][9].
Способы получения и производство триптофана
[править | править код]Химический синтез
[править | править код]Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли.[10] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
[править | править код]У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
[править | править код]В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
[править | править код]Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как сыр, рыба, мясо, бобовые, творог, овёс, арахис, кунжут, кедровый орех, молоко, йогурт.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Арахис является отличным источником триптофана, однако в арахисе его меньше, чем в продуктах животного происхождения.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[11].
Таблица содержания триптофана в продуктах
[править | править код]| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | красная икра | 960 |
| 2 | чёрная икра | 910 |
| 3 | сыр голландский | 780 |
| 4 | миндаль | 630 |
| 5 | кешью | 600 |
| 6 | соевые бобы | 600 |
| 7 | сыр плавленый | 500 |
| 8 | кедровые орехи | 420 |
| 9 | халва | 360 |
| 10 | мясо кролика, индейки | 330 |
| 11 | кальмары | 320 |
| 12 | ставрида | 300 |
| 13 | семечки подсолнуха | 300 |
| 14 | фисташки | 300 |
| 15 | курица | 290 |
| 16 | арахис | 285[13] |
| 17 | горох, фасоль | 260 |
| 18 | сельдь | 250 |
| 19 | телятина | 250 |
| 20 | говядина | 133 |
| 21 | лосось | 220 |
| 22 | треска | 210 |
| 23 | баранина | 210 |
| 24 | творог жирный | 210 |
| 25 | яйца куриные | 200 |
| 26 | минтай | 200 |
| 27 | шоколад | 200 |
| 28 | свинина | 190 |
| 29 | творог нежирный | 180 |
| 30 | карп | 180 |
| 31 | палтус, судак | 180 |
| 32 | крупа гречневая | 180 |
| 33 | пшено | 180 |
| 34 | окунь морской | 170 |
| 35 | скумбрия | 160 |
| 36 | крупа овсяная | 160 |
| 37 | курага | 150 |
| 38 | грибы | 130 |
| 39 | крупа ячневая | 120 |
| 40 | крупа перловая | 100 |
| 41 | хлеб пшеничный | 100 |
| 42 | картофель жаренный | 84 |
| 43 | финики | 75 |
| 44 | рис отварной | 72 |
| 45 | картофель отварной | 72 |
| 46 | хлеб ржаной | 70 |
| 47 | чернослив | 69 |
| 48 | зелень (укроп, петрушка) | 60 |
| 49 | свекла | 54 |
| 50 | изюм | 54 |
| 51 | капуста | 54 |
| 52 | бананы | 45 |
| 53 | морковь | 42 |
| 54 | лук | 42 |
| 55 | молоко, кефир | 40 |
| 56 | помидоры | 33 |
| 57 | абрикосы | 27 |
| 58 | апельсины | 27 |
| 59 | гранат | 27 |
| 60 | грейпфрут | 27 |
| 61 | лимон | 27 |
| 62 | персики | 27 |
| 63 | вишня | 24 |
| 64 | клубника | 24 |
| 65 | малина | 24 |
| 66 | мандарины | 24 |
| 67 | мёд | 24 |
| 68 | сливы | 24 |
| 69 | огурцы | 21 |
| 70 | кабачки | 21 |
| 71 | арбуз | 21 |
| 72 | виноград | 18 |
| 73 | дыня | 18 |
| 74 | хурма | 15 |
| 75 | клюква | 15 |
| 76 | яблоки | 12 |
| 77 | груши | 12 |
| 78 | ананасы | 12 |
Нарушения обмена
[править | править код]Семейная гипертриптофанемия
[править | править код]Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнупа
[править | править код]Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
[править | править код]Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
[править | править код]Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
[править | править код]Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
[править | править код]В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии — миалгии[англ.]. Огласке эта проблема подверглась в 1989, после того как личные врачи трёх американок, обсудив между собой ситуацию, подняли тревогу. Впоследствии масштаб той вспышки оценили как приблизительно равный 60 000 случаев, из которых около 1500 случаев привели к инвалидизации и не менее 27 закончились смертельным исходом.
Было установлено, что практически все заболевшие принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах выявили более 60 различных примесей. Эти примеси, среди которых особенно подозрительными оказались EBT (1,1'-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни у одной из них не выявили способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии.
Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты пытались оценить вероятность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан.
Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привело к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали этому примеру. В феврале 2001 FDA ослабил ограничения, но все же выразил беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»[14]
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными факторами».
Триптофан и иммунная система
[править | править код]Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для клеток, инфицированных вирусом, или раковых клеток.
Триптофан и продолжительность жизни
[править | править код]Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте[15].
Триптофан и сонливость
[править | править код]Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
[править | править код]Триптофан обладает наиболее сильной флуоресценцией среди всех 20 протеиногенных аминокислот. Другие две ароматические аминокислоты, способные к флуоресценции (но в гораздо меньшей степени): тирозин и фенилаланин. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм, в зависимости от молекулярного окружения триптофана. Этот эффект имеет значение для изучения конформации белков. Остатки триптофана, находящиеся в гидрофобном окружении в центре белка, дают смещение спектра его флуоресценции на 10—20 нм в коротковолновую сторону (значения, близкие к 300 нм). Если остатки триптофана расположены на поверхности белка в гидрофильном окружении, то излучение белка смещается в сторону длинных волн (близко к 350 нм). pH раствора также оказывает влияние на флуоресценцию триптофана. Так, при низких значениях pH присоединение атома водорода к карбоксильным группам соседних с триптофаном аминокислот может уменьшать интенсивность его флуоресценции (эффект гашения). Интенсивность флуоресценции триптофана можно значительно повысить, поместив его в органический растворитель, например, ДМСО[16]. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
[править | править код]Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
[править | править код]Гипотеза о том, что при депрессивных расстройствах уменьшается содержание в мозге серотонина, привела к терапевтическому использованию L-триптофана при депрессии[4]. Он применяется как в качестве монотерапии, так и в сочетании с традиционными антидепрессантами[4].
Имеются данные контролируемых испытаний, согласно которым добавление L-триптофана может усиливать терапевтический эффект антидепрессантов группы ИМАО. Назначение L-триптофана рекомендуется для дополнительного потенцирования серотонинергических эффектов комбинаций «литий + ИМАО» и «литий + кломипрамин»(«серотониновый коктейль»)[17].
Также L-триптофан используется при обсессивно-компульсивном расстройстве. Дополнительное введение L-триптофана в дозе 6—8 г в сутки особенно оправдано при снижении синтеза или истощении запасов серотонина, например вследствие длительного применения серотонинергических антидепрессантов. При этом у части больных терапевтический эффект L-триптофана при длительном лечении склонен истощаться[18].
Кроме того, препараты L-триптофана назначаются при расстройствах сна[19], чувстве страха и напряжения, дисфории, предменструальном синдроме[источник не указан 3422 дня]. Показаниями к применению также являются комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечение биполярного аффективного расстройства и депрессии, связанной с менопаузой[источник не указан 3422 дня]. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Побочными действиями L-триптофана являются гипотензия, тошнота, поносы и рвота[19], анорексия. Кроме того, он вызывает сонливость днём, а если принимать его вечером — может улучшать ночной сон[4]. Сочетанное применение серотонинергических антидепрессантов и L-триптофана может вызывать серотониновый синдром[18]. При сочетанном применении триптофана и антидепрессантов группы ИМАО возможны возбуждение ЦНС, спутанность сознания (следует снизить дозу триптофана)[20].
Триптофан также применяется для сбалансирования кормов для животных.
Примечания
[править | править код]- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) (англ.) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Леенсон И. А. Язык химии. Этимология химических названий. — М.: АСТ, Corpus, 2016. — 464 с. — ISBN 978-5-17-095739-2. Архивировано 6 мая 2019 года.
- ↑ Бокуть С. Б., Герасимович Н. В., Милютин А. А. Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации / под ред. Мельник Л. С., Касьяновой Л. Д.. — Минск: Вышэйшая школа, 2005. — 463 с. — 3000 экз. — ISBN 985-06-1045-X.
- ↑ 1 2 3 4 Гельдер М., Гэт Д., Мейо Р. Оксфордское руководство по психиатрии: Пер. с англ. — Киев: Сфера, 1999. — Т. 2. — 436 с. — 1000 экз. — ISBN 966-7267-76-8.
- ↑ Kostowski W., Bidzinski A., Hauptmann M., Malinowski J. E., Jerlicz M., Dymecki J. Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study (англ.) // Pol J Pharmacol Pharm : journal. — 1978. — Vol. 30, no. 1. — P. 41—7. — PMID 148040. (англ.)
- ↑ Turner E. H., Loftis J. M., Blackwell A. D. Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan (англ.) // Pharmacol Ther : journal. — 2006. — Vol. 109, no. 3. — P. 325—338. — doi:10.1016/j.pharmthera.2005.06.004. — PMID 16023217. (англ.)
- ↑ Hardebo J. E., Owman C. Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface (англ.) // Ann NeurolAnn Neurol : journal. — 1980. — Vol. 8, no. 1. — P. 1—31. — doi:10.1002/ana.410080102. — PMID 6105837. (англ.)
- ↑ Gustafsson B. I., Tømmerås K., Nordrum I., Loennechen J. P., Brunsvik A., Solligård E., Fossmark R., Bakke I., Syversen U., Waldum H. Long-term serotonin administration induces heart valve disease in rats (англ.) // Circulation[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2005. — March (vol. 111, no. 12). — P. 1517—1522. — doi:10.1161/01.CIR.0000159356.42064.48. — PMID 15781732. (англ.)
- ↑ Xu J., Jian B., Chu R., Lu Z., Li Q., Dunlop J., Rosenzweig-Lipson S., McGonigle P., Levy R. J., Liang B. Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells (англ.) // Am. J. Pathol.[англ.] : journal. — 2002. — December (vol. 161, no. 6). — P. 2209—2218. — doi:10.1016/S0002-9440(10)64497-5. — PMID 12466135. — PMC 1850896. Архивировано 3 апреля 2010 года. (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания. Дата обращения: 5 июля 2009. Архивировано из оригинала 19 июня 2009 года.
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
- ↑ Под ред. М. Ф. Нестерина и И. М. Скурихина. Химический состав пищевых продуктов..
- ↑ Information Paper on L-Tryptophan and 5-hydroxy-L-tryptophan Архивная копия от 17 августа 2014 на Wayback Machine, FDA, February 2001 (англ.)
- ↑ H. Ooka, P. E. Segall, P. S. Timiras. Histology and survival in age-delayed low-tryptophan-fed rats (англ.) // Mechanisms of Ageing and Development : Научный журнал. — 1988. — Vol. 43, no. 1. — P. 79—98. — ISSN 0047-6374. — doi:10.1016/0047-6374(88)90099-1. — PMID 3374178.
- ↑ Intrinsic Fluorescence of Proteins and Peptides. web.archive.org (16 мая 2010). Дата обращения: 4 февраля 2020. Архивировано 16 мая 2010 года.
- ↑ Быков Ю. В. Резистентные к терапии депрессии. — Ставрополь, 2009. — 74 с. Архивировано 7 ноября 2011 года.
- ↑ 1 2 Мосолов С.Н. Современные тенденции в терапии обсессивно-компульсивного расстройства: от научных исследований к клиническим рекомендациям // Биологические методы терапии психических расстройств (доказательная медицина — клинической практике) / Под ред. С.Н. Мосолова. — Москва : Издательство «Социально-политическая мысль», 2012. — С. 669—702. — 1080 с. — 1000 экз. — ISBN 978-5-91579-075-8.
- ↑ 1 2 Тёлле Р. Психиатрия с элементами психотерапии / Пер. с нем. Г. А. Обухова. — Минск: Вышэйшая школа, 1999. — 496 с. — 4000 экз. — ISBN 985-06-0146-9.
- ↑ Руководство по рациональному использованию лекарственных средств (формуляр) / Под ред. А. Г. Чучалина, Ю. Б. Белоусова, Р. У. Хабриева, Л. Е. Зиганшиной. — ГЭОТАР-Медиа. — М., 2006. — 768 с. — ISBN 5-9704-0220-6.