Гидрид ксантана
Гидрид ксантана
| |
|---|---|
Общие
| |
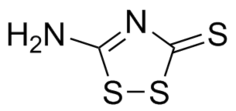
| Систематическое наименование | 5-амино-1,2,4-дитиазол-3-тион
|
| Хим. формула | C₂H₂N₂S₃ |
Физические свойства
| |
| Состояние | жёлтые кристаллы |
| Молярная масса | 150,25 г/моль |
Термические свойства
| |
| Т. плав. | 202 °С разл. |
Химические свойства
| |
| Растворимость в воде | диметилсульфоксид |
Классификация
| |
| Номер CAS | 6846-35-1 |
| PubChem | 2735329 |
| Номер EINECS | 229-933-3 |
N=c1nc(S)ss1
| |
InChI=1S/C2H2N2S3/c3-1-4-2(5)7-6-1/h(H2,3,4,5)
| |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Гидрид ксантана — органический реагент для переноса серы в процессах вулканизации, сульфирования олигонуклеотидов до тиофосфатных олигонуклеотидов, а также для синтеза некоторых тиадиазолов и дитиазолов[1].
Получение
[править | править код]Считается, что впервые гидрид ксантана из хлороводорода и тиоцианата ртути(I) получил Фридрих Вёлер в 1821 году, однако охарактеризовано вещество было лишь в 1842 году. Другой способ, заключающийся в обработке серной кислотой ионных тиоцианатов калия, натрия и аммония, подходит для получения небольших количеств вещества[1].
В промышленности гидрид ксантана получают электролизом тиоцианата аммония или по реакции между цианамидом кальция с серой и дисульфидом углерода[1].
Строение
[править | править код]В ранней литературе существовали неоднозначные сведения об истинной структуре гидрида ксантана, поскольку в основных условиях он легко изомеризуется в надтиоциановую кислоту (1,2,4-тиадиазол-3,5-дитиол). Кроме того, для обоих соединений существуют таутомерные структуры. Поскольку не существовало методов для надёжного определения структуры, в литературе его часто обозначали как 1,2,4-дитиазольный изомер либо приписывали ему название надтиоциановой кислоты. В начале XX века вопрос прояснили Фройнд и Ганч, но в течение некоторого времени проблемы с номенклатурой и структурными формулами оставались. Для того, чтобы убедиться, что статья ссылается именно на гидрид ксантана (изонадтиоциановую кислоту) или на надтиоциановую кислоту, целесообразно свериться с методикой получения описываемого соединения[1].
Реальная структура гидрида ксантана была однозначно установлена методом инфракрасной спектроскопии и кристаллографическими исследованиями[1].
Использование
[править | править код]Перенос серы
[править | править код]S–S-связь в гидриде ксантана способна разрываться при нагревании. При этом вещество выступает донором элементарной серы, что используется в процессах активации или вулканизации резины в промышленности. Масс-спектрометрическое исследование показало, что реакционноспособными заряженными и незаряженными частицами в данном случае являются HN2CS, HNCS, CS и S2[1].
Тиофосфатные олигонуклеотиды
[править | править код]Недавно было установлено, что гидрид ксантана может выступать удобным реагентом в твердофазном синтезе тиофосфатных олигонуклеотидов амидофосфитным методом. Он используется на стадии сульфирования после сочетания очередного амидофосфитного блока и образования эфирной связи. Эффективность переноса серы позволяет снизить стоимость производства тиофосфатных олигонуклеотидов[1].
Данная реакция изучалась в различных растворителях: в ацетонитриле, хлористом метилене и этаноле продукт получался практически с количественным выходом. Также показана эффективность использования гидрида ксантана на твёрдой подложке[1].
Синтез гетероциклических соединений
[править | править код]Реагент был использован для синтеза ряда тиадиазолов и 1,3-тиазинов[1].
Хранение и безопасность
[править | править код]Соединение устойчиво при комнатной температуре и неактивно по отношению к влаге или воздуху. Несовместимо с окислителями. LD50 для мышей и крыс составляет 0,6 и 2,2 мг/кг соответственно. У животных оно способно накапливаться и вызывать белковую и жировую дистрофию печени, нарушать баланс витамина С, ингибировать ферменты, раздражать слизистые оболочки глаза в течение 14 дней после нанесения[1].