Иодид индия(III)
Перейти к навигации
Перейти к поиску
| Иодид индия(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Иодид индия |
| Традиционные названия | Иодистый индий |
| Хим. формула | InI3 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 495,53 г/моль |
| Плотность | 4,68; 4,69; 4,72 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 199; 207; 210 °C |
| • кипения | 447 °C |
| Энтальпия | |
| • образования | -235 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 130822 г/100 г [3] |
| • в этаноле, диэтиловом эфире, хлороформе | растворяется |
| Классификация | |
| Рег. номер CAS | 13510-35-5 |
| PubChem | 24865877 |
| Рег. номер EINECS | 236-839-6 |
| SMILES | |
| InChI | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
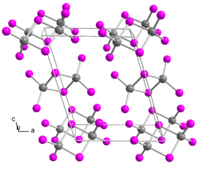
Иодид индия — бинарное неорганическое соединение, соль металла индия и иодистоводородной кислоты с формулой InI3, жёлтые кристаллы, образует кристаллогидрат, молекулы димерны.
Получение
[править | править код]- Непосредственное взаимодействие элементов [4]:
Физические свойства
[править | править код]Иодид индия образует жёлтые кристаллы моноклинной сингонии, пространственная группа P 21/c, параметры ячейки a = 0,9837 нм, b = 0,6102 нм, c = 1,2195 нм, β = 107,69°, Z = 2 [5].
Молекулы иодида индия димеризованы в кристаллах и в газовой фазе, то есть молекулярная формула In2I6.
Очень хорошо растворяется в воде. Образует кристаллогидрат состава InI3•2H2O.
Химические свойства
[править | править код]- Реагирует с разбавленными щелочами:
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химия и технология редких и рассеянных элементов, ч. I / Под ред. К. А. Большакова. — М.: Высш. школа, 1976. — 368 с.
- Неорганическая химия. / Под ред. Третьякова Ю.Д.. — М.: Изд. центр «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1.
Примечания
[править | править код]- ↑ Киргинцев А. Н., Трушникова А. Н., Лаврентьева В. Г. Растворимость неорганических веществ в воде. — Л.: Химия, 1972. — 248 с.
- ↑ Von F. Ensslin, B. Ziemeck, L. de Schäpdryver. Die Löslichkeit von Indium(III)-chlorid, Indium(III)-bromid und Indium(III)-jodid im Wasser bei verschiedenen Temperaturen // Zeitschrift für Anorganische und Allgemeine Chemie. — 1947. — Т. 254, № 5-6. — С. 293-296.
- ↑ Лидин Р.А. и др. Константы неорганических веществ. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
- ↑ Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 3. — 392 с.
- ↑ Forrester J. D., Zalkin A., Templeton D. H. Crystal and Molecular Structure of Indium(III) Iodide (In2I6) // Inorganic Chemistry. — 1964. — Т. 3, № 7. — С. 63-67.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |

