Сопряжённое присоединение по Михаэлю
Реакция Михаэля — это нуклеофильное присоединение карбаниона или другого нуклеофильного агента к α,β-ненасыщенному карбонильному соединению.[1] Описываемая реакция относится к большому классу реакций сопряжённого присоединения. Это один из лучших методов для создания С-С связей. В настоящее время существует большое количество модификаций этой реакции, в том числе асимметрических.[2]

Механизм
[править | править код]Механизм реакции, где в качестве нуклеофильного агента выступает 1, выглядит следующим образом:

Депротонирование 1 основанием приводит к образованию 2, который стабилизирован электроно-акцепторными карбонильными группами. Структуры 2А-2С являются резонансными структурами, две из которых представляют собой енолят-ионы. Образовавшийся нуклеофил реагирует с электрофильным алкеном 3 с образованием 4 в реакции сопряжённого присоединения. В заключительной стадии протонируется получившийся енолят-ион с образованием 5.
Направление реакции определяется в большей степени орбитальными, нежели электростатическими, факторами. ВЗМО стабилизированного енолят-иона имеет большой коэффициент на центральном атоме углерода, в то время как НСМО многих α,β-ненасыщенных карбонильных соединений имеет большой коэффициент на β-атоме углерода. Таким образом оба реагента могут рассматриваться как мягкие. Такие граничные орбитали обладают одинаковой энергией и эффективно реагируют, образуя новую С-С связь.
Как и альдольная реакция, реакция Михаэля может протекать через образование енола, эфира силильного енола в реакции Мукаиямы — Михаэля, или чаще — через енолят-ион. В последнем случае стабилизированное карбонильное соединение депротонируется сильным основанием или кислотой Льюиса и слабым основанием. Образовавшийся енолят-ион атакует активированный алкен с 1,4-региоселективностью, образуя углерод-углеродную связь.
В большинстве случаях реакция при низких температурах необратима.
Асимметричная реакция Михаэля
[править | править код]Последние исследования были направлены на расширение сферы применения асимметричной реакции Михаэля. На сегодняшний момент наиболее распространённые методы основаны на применении хиральных межфазных катализаторов, таких как, асимметричные четвертичные соли аммония.
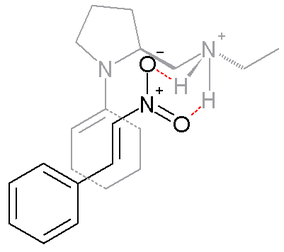
В реакции между циклогексаноном и β-нитростиролом, изображённой ниже, производное пролина, в качестве основания, действует совместно с протонной кислотой, такой как п-толуолсульфоновая кислота:[3]

В реакции значительно преобладает продукт син-присоединения. Предполагается, что подобная селективность в переходном состоянии наблюдается за счёт енамина, образующегося в реакции между пролином и кетоном, и β-нитростирола, которые образуют устойчивый интермедиат, однозначно определяющий направление дальнейших превращений.
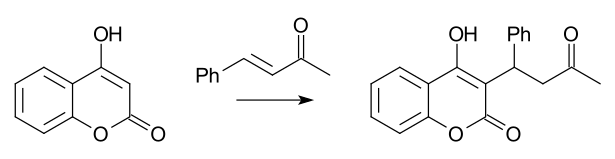
Известным примером асимметричной реакции Михаэля является синтез варфарина из 4-гидроксикумарина и 4-фенил-3-бутен-2-она, впервые осуществлённый ещё в 1944 году.[4]
Существует несколько асимметричных версий этой реакции с использованием хиральных катализаторов.
Реакция Мукаиямы — Михаэля
[править | править код]В реакции Мукаиямы[нем.] — Михаэля нуклеофилом является силиловый эфир, а в качестве катализатора обычно выступает тетрахлорид титана:[5]

Историческая справка
[править | править код]Предпосылкой исследования Артура Михаэля 1887 года являлась публикация[6] 1884 года, в которой описывалась реакция этил-2,3-дибромпропионата с диэтилмалонатом натрия с образованием производного циклопропана.

Михаэлю удалось получить тот же продукт, заменив пропионат на этиловый эфир 2-бромакриловый кислоты. Он предположил, что эта реакция протекает как присоединение к двойной связи акриловой кислоты. Затем он подтвердил это предположение, взаимодействием диэтилмалоната и этилового эфира коричной кислоты:[7]

В том же году Р. Л. Кляйзен утверждал, что открыл данную реакцию раньше. По его словам в 1883 году он и Т. Комненос наблюдали продукты присоединения к двойным связям как побочные продукты реакции конденсации малоновой кислоты с альдегидами.[8] Тем не менее, согласно биографу Такаси Токорояме, это утверждение является необоснованным.
Примечания
[править | править код]- ↑ Little, R. D.; Masjedizadeh, M. R.; Wallquist, O.; McLoughlin, J. I. The Intramolecular Michael Reaction // Org. React.. — 1995. — № 47. — С. 315–552.
- ↑ Hunt, I. Chapter 18: Enols and Enolates – The Michael Addition reaction. — University of Calgary.
- ↑ Pansare, S. V.; Pandya, K. Simple Diamine- and Triamine-Protonic Acid Catalysts for the Enantioselective Michael Addition of Cyclic Ketones to Nitroalkenes // Journal of the American Chemical Society. — 2006. — № 128 (30). — С. 9624–9625.
- ↑ Ikawa, M.; Stahmann, M. A.; Link, K. P. Studies on 4-Hydroxycoumarins. V. The Condensation of α,β-Unsaturated Ketones with 4-Hydroxycoumarin // Journal of the American Chemical Society. — 1944. — № 66 (6). — С. 90.
- ↑ Mukaiyama, T. (1977). «Titanium Tetrachloride in Organic Synthesis [New synthetic methods (21)]». Angew. Chem., Int. Ed. Engl. 16 (12): 817—826. doi:10.1002/anie.197708171
- ↑ Conrad, M.; Guthzeit, M. (1884). «Ueber die Einwirkung von α-β-Dibrompropionsäure auf Malonsäureester». Berichte der Deutschen Chemischen Gesellschaft 17 (1): 1185—1188. doi:10.1002/cber.188401701314
- ↑ Tokoroyama, T. (2010). «Discovery of the Michael Reaction». European Journal of Organic Chemistry 2010 (10): 2009—2016. doi:10.1002/ejoc.200901130.
- ↑ Komnenos, T. (1883). «Ueber die Einwirkung von Fettaldehyden auf Malonsäure und Aethylmalonat». Justus Liebig’s Annalen der Chemie 218 (2): 145—167. doi:10.1002/jlac.18832180204