Участник:Kumofly/Болезнь Гентингтона
Это временная версия статьи Болезнь Хантингтона. |
| Болезнь Гентингтона (HD) | |
|---|---|
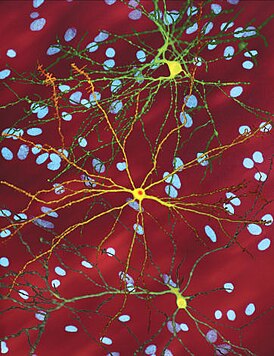 An edited microscopic image of medium spiny neurons (yellow) with nuclear inclusions (orange), which occur as part of the disease process, image width 360 µm | |
| МКБ-10 | G10, F02.2 |
| МКБ-9 | 333.4, 294.1 |
| OMIM | 143100 |
| DiseasesDB | 6060 |
| MedlinePlus | 000770 |
| eMedicine | article/1150165 article/792600 article/289706 |
| MeSH | D006816 |
Болезнь Гентингтона (англ. Huntington's Disease, HD) — тяжелое нейродегенеративное наследственное заболевание[1], влияющее на координацию мышц человека и приводящее к изменениям в поведении, душевном состоянии и когнитивных функциях[2][3] и возникающее из-за поражения нейронов головного мозга. Сами симптомы и скорость их развития могут различаться от человека к человеку, в том числе и между родственниками, однако в целом болезнь имеет предсказуемый сценарий развития. В продромальном периоде болезни происходят относительно небольшие изменения в настроении и мышлении, в частности, наблюдается повышенное беспокойство и ухудшается сон, а первыми видимыми симптомами являются гиперкинезы (так называемая "хорея"), неустойчивая походка и иные нарушения координации тела. По мере дальнейшего развития болезни вышеперечисленные симптомы только усугубляются, что фактически приводит человека к невозможности согласованно и самостоятельно выполнять физические движения. Психическое состояние индивида тоже ухудшается: наблюдается общее снижение умственных способностей, что постепенно приводит к деменции[4]. Это обусловлено нейроморфологическими изменениями, характеризуемыми атрофией нейронов в базальных ганглиях, а на поздней стадии также атрофией нейронов коры головного мозга. Из-за проблем с контролем тела больные нередко подвергаются падениям и столкновениям с твердыми поверхностями и предметами, что может привести к опасным травмам. На поздних стадиях болезнь негативно влияет на сердце и лёгкие, что приводит к осложнениям в виде сердечной недостаточности и пневмонии. В большинстве случаев именно осложнения, а не сама болезнь, являются основной причиной сокращения жизни пациентов: смерть обычно наступает через 15-20 лет после манифестации болезни. Возраст начала заболевания имеет очень большой разброс: первые симптомы могут проявиться как в юности, так и в очень пожилом возрасте, но в среднем манифестация болезни наступает в возрасте 35-44 лет. Причиной заболевания является мутация в ДНК, которая может передаться последующим поколениям. Статистически у потомков наблюдается снижение возраста начала болезни. Примерно в 7% случаев симптомы начинают проявляться до 21 года и характеризуются гипокинезией; в этом случае болезнь прогрессирует намного быстрее и не имеет особых различий в симптомах между индивидами. Обычно этот вариант называют ювенильной, ригидной или Вестфаль-формой.
Болезнь Гентингтона является одной из самых частых генетически обусловленных причин возникновения так называемой хореи — синдрома беспорядочных и неконтролируемых движений тела и мимики лица, поэтому это заболевание часто еще называют "хореей Гентингтона". Болезнь возникает из-за аутосомно-доминантной мутации как минимум одного из двух копий гена человека, который называется гентингтином. Носитель гена может передать мутацию каждому потомку с вероятностью в 50%. Ген гентингтина кодирует белок, который также называется гентингтином. У гена имеется непостоянная по длине часть, содержащая повторы триплета ЦАГ (цитозин-аденин-гуанин, CAG), и при большом количестве этих повторов белок гентингтин меняет свои свойства: он становится токсичным и повреждает клетки головного мозга. Функции белка гентингтина до сих пор плохо изучены. Для проверки количества повторов в любом возрасте можно провести генетическое тестирование, что влечёт за собой некоторые этических вопросы: какой возраст проверяющего считается достаточным для проведения проверки; имеют ли родители право решения на проведение теста за ребенка; как решать проблемы конфиденциальности при разглашении информации и т. д. Для решения этих проблем существуют разработанные стандарты медико-генетического консультирования, которые могут стать рабочими моделями для других генетический заболеваний.
На текущее время эффективного лечения болезни не существует и пациенты на поздних стадиях нуждаются в круглосуточном уходе. Существующие фармакологические и иные методы лечения лишь облегчают течение симптомов. Болезнь чаще всего встречается в западноевропейских странах, реже - в Азии и Африке. Пол индивида значения не имеет.
Генетическая природа болезни была обнаружена в 1993 году усилиями различных международных групп исследователей, возглавляемых Фондом наследственных заболеваний (Hereditary Disease Foundation). Организации по исследованиям и поддержке пациентов, которые начали появляться в 60-х годах XX века, работают над повышением информированности общества о болезни, предоставляют помощь и поддержку носителям и больным, а также членам их семей, и проводят различные научные и социологические исследования. На сегодняшний день главными направлениями исследований является выяснение точных механизмов болезни с применением технологий моделирования на животных, создание и тестирование лекарств, которые позволили бы замедлить или даже остановить течение болезни; изучение терапии с помощью стволовых клеток для восстановления поврежденных участков головного мозга; возможность использования генной терапии; улучшение симптоматического лечения больных.
Название "Болезнь Гентингтона" для заболевания на данный момент является принятым в российском научном сообществе, однако в информационных источниках нередко могут использоваться и другие названия: синдром Гентингтона, хорея Гентингтона или Хантингтона, также часто используются сокращения "БГ" или "ХГ".
Сигналы и симптомы
[править | править код]Первые симптомы общего характера болезни Гентингтона в среднем начинают проявляются в возрасте от 35 до 44 лет, однако заболевание может начать прогрессировать как в детском, так и в преклонном возрасте. На ранних стадиях обычно возникают проблемы с координацией тела и диагностируют изменения в мышлении и поведении, однако эти симптомы часто имеют весьма слабое проявление, и их нельзя четко ассоциировать с болезнью. Надо отметить, что если физические способности тела у больных страдают примерно одинаковым образом, нарушения мышления и поведения имеют заметные отличия.
Наиболее характерным симптомом при манифестации заболевания являются случайные и неконтролируемые движения, называемые хореей. Хорея может начаться как общее беспокойство, слабые непреднамеренные и неконтролируемые движения, потеря равновесия или замедление саккадических движений глаз. Эти небольшие моторные нарушения в дальнейшем приводят к более серьезным проблемам с движениями в течение последующих трех лет. Далее все более отчетливо начинают проявляться симптомы ригидности, "танцевальные" движения или нетипичные позы тела, которые обусловлены прогрессированием развития болезни: эти сигналы явно говорят о процессе атрофии частей головного мозга, отвечающие за координацию тела. Психомоторные функции всё более ухудшаются, что приводит к повышению усилий по контролю работы мышц. Общими проявлениями являются физическая нестабильность, ненормальные выражения лица, трудности с жеванием, глотанием и речью. Проблемы с принятием пищи являются общей причиной потери веса и требует решения задачи обеспечения полноценного питания. Общим симптомом является нарушения сна. Ювенильная форма БГ отличается от всех вышеописанных симптомов тем, что развивается намного быстрее, и основным признаком болезни выступает ригидность (хотя кратковременная хорея и может быть выражена). Судороги тоже могут часто наблюдаться у пациентов.
Когнитивные способности при болезни имеют склонность к угнетению. Особенно страдают исполнительные функции, которые включают в себя планирование, абстрактное мышление и его гибкость, соблюдение правил, выполнение подходящих к ситуации действий и подавление нежелательного поведения. Во время дальнейшего прогрессирования болезни начинаются проблемы с памятью. Они регистрируются в широких пределах от дисфункции кратковременной памяти до расстройства долговременной, в том числе повреждается эпизодическая (напр. память событий в жизни), процедурная (мышечная и иная память тела, позволяющая осуществлять сознательную деятельность) и профессиональная память. Когнитивные проблемы нарастают все время, в конце концов достигая стадии деменции. Эта модель расстройства называется субкортикальным синдромом деменции и его следует отличать от других, в частности возникаемых при болезни Альцгеймера.
В практике так же выявлены нейропсихиатрические проявления тревоги, депрессии, эмоциональной тупости, эгоцентризм, агрессия и компульсивное поведение; последнее может вызвать или усугубить гиперсексуальность, пристрастие к алкоголю, наркотикам, азартным играм и т.д. Наблюдаются сложности с распознаванием негативных выражений эмоций других людей. Следует отметить, что распространенность этих симптомов значительно отличается между исследованиями: по их оценкам она составляет от 33% до 76%. Для носителей мутации и их семей именно психические отклонения являются наиболее печальным и трудным аспектом болезни. Они очень сильно влияют на их повседневный быт, и часто являются причиной институционализации. Суицидальные мысли и попытки самоубийства среди пациентов БГ происходят чаще, чем в общей популяции. Часто люди снижают степень понимания ситуации, проблем с координацией тела, когнитивных и эмоциональных отклонений.
Мутантный гентингтин экспрессируется на весь организм, и это приводит к проблемам не только в головном мозге, но и в периферийных тканях. Эти нарушения включают в себя атрофию мыщц, сердечную недостаточность, нарушение толерантности к глюкозе (сахарный диабет), потерю веса, остеопороз и атрофию яичек.
Генетика
[править | править код]В геноме всех людей содержатся две копии гена гентингтина (HTT), которые содержат генетическую информацию о белке, который также называется гентингтин (Htt). Этот ген также называется IT15 (interesting transcript 15), еще одно название - HD. Часть этого гена содержит повторяемые элементы, которые имеют название тринуклеотидных повторов (цитозин-аденин-гуанин, CAG), и их количество может варьировать у разных людей и возрастать/уменьшаться от поколения к поколению. Если длина этих повторяющихся секторов превышает некоторое значение, то в этом случае образуется белок с измененной структурой, а именно мутантная форма белка гентингтина (mHTT). Различие в функциях этого белка приводит к патологическим изменениям, которые обуславливают развитие симптомов болезни. Мутация болезни Гентингтона генетически доминантна и почти всегда полностью пенетрантна: наличие mHTT в любой аллели приводит к болезни. Зависимость от пола не выявлена, однако степень изменения количества повторов при передаче гена может изменяться в зависимости от пола родителя.
Природа мутации
[править | править код]Болезнь относится к расстройствам тринуклеотидных повторов, которые вызваны превышением нормального числа повторяемых участков гена. Ген HTT находится на коротком плече 4-й хромосомы – 4p16.3. Он содержит последовательность из трех оснований ДНК – цитозина (Ц), аденина (А) и гуанина (Г), которая повторяется несколько раз (имеет вид ...ЦАГЦАГЦАГ…). Эта последовательность известна как тринуклеотидный повтор. ЦАГ – это трехбуквенный генетический код (кодон) для аминокислоты глутамина, серия которых участвует в производстве цепочки глутамина, называемый полиглутаминовым трактом (или трактом polyQ), а повторяемая часть гена – регионом polyQ.
| Количество | Тип аллели | Статус развития | Риск передачи |
|---|---|---|---|
| <26 | Нормальный | Нет | Нет |
| 27–35 | Пограничный | Нет | Возможно, но <<50% |
| 36–39 | С частичной пенетрантностью | Редко | 50% |
| 40+ | С полной пенетрантностью | Всегда | 50% |
Обычно человек обладает менее чем 36 повторами последовательности кодона глутамина в регионе polyQ, из которого производится цитоплазматический белок гентингтин. Однако параметры белка начинают меняться, если число этих повторов превысит значение 36. Такая измененная форма белка, называемый mHtt, увеличивает скорость распада некоторых типов нейронов. Влияние этого белка различно для различных частей мозга из-за отличий в количестве нейронов и их типов. Обычно количество повторов ЦАГ показывает, насколько сильно будет это влияние, и с корреляцией примерно в 60% определяет возраст начала проявления симптомов. Такая неопределенность в возрасте начала болезни обсуловлена различиями в окружении людей и их в особенностях генетического кода, которые могут влиять на работу гена HTT или взаимодействовать с ним. При наличии 36-39 повторяемых участков ЦАГ наблюдается форма болезни с частичной пенетрантностью: данная форма имеет позднее начало и вялотекущей динамику развития симптомов, а в ряде случае манифестация не происходит вовсе. При больших числах болезнь полностью пенетрантна и в некоторых случаях симптомы могут возникнуть до 20-летнего возраста. Такая форма болезни называется ювенильной, акинетически ригидной или Вестфаль-формой и она диагностируется у примерно 7% носителей.
Наследование
[править | править код]Болезнь Гентингтона имеет аутосомно-доминатный тип наследования. Это означает, что носитель обычно имеет одну копию с увеличенным количеством тринуклеотидных повторов (мутантную аллель) с родителя-носителя. Из-за высокой пенетрантности мутации эта копия приведет к болезни. При таком типе наследования каждый потомок аффектного индивида имеет 50%-й риск наследования мутантной аллели и, следовательно, возникновения болезни (смотри рисунок). Вероятность не меняется от пола человека.
Если число повторов ЦАГ превысит 28, то при передаче тринуоклетидные повторы становятся нестабильными и имеют тенденцию к увеличению, то есть ген становится динамическим: каждое поколение, в основном, будет иметь большее число повторов вместо того, чтобы передать ген как есть. Это означает, что в какой-то момент неподверженный к болезни индивид с “пограничным” значением повторов (28-35) и значений с частичной пенетрантностью (36-39) может передать ген, который будет иметь форму полной пенетрантности (40 и выше). Подобный рост числа повторов (и, следовательно, уменьшение возраста начала болезни) при передаче последующим поколениям называется генетической антиципацией. Нестабильность при передаче больше наблюдается в сперматогенезе, чем в оогенезе: при наследовании с материнской линии число повторов обычно не меняется или меняется незначительно (в среднем 2 повтора в обе стороны). При наследовании с отцовской линии риск повышения числа повторов намного выше и само приращение может достигать нескольких десятков повторов. Новые мутации гена HTT обнаруживаются редко.
В особых случаях оба родителя могут иметь по одной мутантной аллели. В этом случае риск передачи мутации увеличивается до 75%. Если же оба родителя имеют по два мутатных аллеля (что еще реже встречается на практике), то риск передачи станет равным 100%: все дети от этих родителей будут подвержены болезни. Некоторое время считалось, что вторая мутантная аллель не влияет на сами симптомы и их прогрессирование, однако на данный момент найдены доказательства влияния второй аллели на фенотип и скорость развития заболевания.
Механизм влияния
[править | править код]Белок Htt взаимодействует с более чем 100 другими белками и на данный момент известна важность биологических функций этого белка в организме человека. Поведение мутантного варианта белка гентингтина не до конца понятно, но точно известно о токсичном воздействии на некоторые типы клеток, в особенности, головного мозга. Самые первые повреждения чаще всего фиксируются в базальных ганглиях (стриатуме), но по мере развития заболевания мутация затрагивает и другие зоны мозга, которые наиболее подвержены воздействию. Ранние симптомы болезни, такие как нарушение двигательных функций, контроля настроения и прочие изменения, связаны с нарушениями работы базальных ганглий.
Функция белка Htt
[править | править код]Htt выделяется во всех клетках млекопитающих. В наибольшей концентрации они обнаруживаются в головном мозге и яичках, в меньших количествах также обнаруживаются в печени, в сердце и лёгких. На данный момент функция этого белка в людях до конца не выяснена. Он взаимодействует с белками, отвечающие за процессы транскрипции, передачи сигналов между клетками и внутриклеточной транспортировки веществ. При тестировании на животных с изменениями генома, влияющие на синтез белка Htt, были обнаружены некоторые его функции. Htt имеет важное значение в эмбриональном развитии у этих животных, и отсутствие Htt приводит к смерти эмбриона. Каспазы, ферменты, играющие роль катализатора процесса апоптоза, при наличии мутантного гена активизируются путем повреждения системы убиквитин-протеазы. Он также участвует как антиапоптозный агент для предотвращения запрограммированной смерти клеток и контролирует производство нейротрофического фактора мозга (BDNF), белка, имеющий функции нейропротектора и регулятора процесса нейрогенеза. Htt также способствует работе везикулярного транспорта и синаптической передачи, а также контролирует нейрональную транскрипцию генов. При увеличении синтеза белка Htt выживаемость клеток мозга увеличивается и эффекты mHtt ослабевают, при уменьшении Htt влияние mHtt начинает расти. При нарушении работы нормального гена у людей болезнь не развивается и на данный момент считается, что именно токсичное воздействие белка mHtt приводит к заболеванию.
Клеточные изменения, связанные с mHtt
[править | править код]Токсичное воздействие mHtt приводит к многочисленным изменениям в клетках и эти процессы являются определяющими в развитии патологии. Во время процесса посттранляционной модификации mHtt расщепление белка может оставить короткие фрагменты, состоящие из частей полиглутаминового расширения. Полярная природа глутамина вызывает взаимодействие с иными белками при его избытке в неизменном варианте белка Htt или в его фрагменте, созданных в процессе расщепления Htt. Отсюда следует, что нити молекул mHtt вместо сврачивания в функциональный белок начнет образовывать водородные связи между собой, формируя белковый агрегат. С течением времени количество этих агрегатов будет расти, что в конечном счете начнет приводить к проблемам работы нейрона: эти фрагменты могут слипаться, образуя тельца включения внутри клетки. Этот процесс называется белковой аггрегацией. Включения в нейронах приводит к непрямой интерференции. Избыточное количество белков, слипаясь между собой на аксонах и дендритах, начинают препятствовать механической передаче нейромедиаторов и в итоге везикулы перестают перемещаться сквозь цитоскелет. В конце концов, с каждым следующим промежутком времени в наличии остается всё меньше и меньше нейромедиаторов, доступных для сигнализации других нейронов по мере увеличения числа включений в нейронах. Эти тельца обнаруживаются как в ядре клетки, так и в цитоплазме. Тельца включения являются одним из самых ранних паталогических изменений в головном мозге. Эксперименты выявляют разные свойства этих телец: одни обнаружили токсическое воздействие на нейроны головного мозга, других наоборот, утверждают, что тельца могут выполнять функцию защиты нейрона.
Обнаружено несколько путей того, как mHtt вызывает смерть клетки:
- влияние на белков-шаперонов, которые участвуют в процессе фолдинга белка;
- взаимодействие с каспазами, играющие роль в процессе апоптоза;
- токсичный воздействие глутамина на нервные клетки;
- нарушения в процессе выработки энергии в клетке из-за нарушений работы митохондрий;
- влияние на процесс экспрессии генов.
Цитотоксический эффект белка mHtt значительно повышается при взаимодействии с белком Rhes, который в основном выделяется стриатумом. Rhes участвует в процессе сумоилирования, во время которого создаются сгустки белков, однако mHtt расщепляет их. Эксперименты с клеточными культурами показывают, что сгустки по своему влиянию менее токсичны, чем их расщепленный вариант.
Существуют еще одна теория, описывающая механизм влияния на функции клетки: повреждения митохондрий клеток стриатума (вследствие этого наблюдаются снижение уровня энергетического обмена веществ) и взаимодействия измененной формы белка гентингтина с другими белками в нейронах приводит к увеличению концентрации глутамина, который, как было установлено, имеет токсические свойства при больших количествах. Это может привести к многочисленным повреждениям различных клеточных структур. Исследования не показывают какого-либо увеличения количества глутамина у лиц с болезнью Гентингтона, однако высказывается мнение, что из-за повышенной уязвимости клеток даже нормальное количество глутамина негативно влияет на них.
Макроскопические изменения, связанные с mHtt.
[править | править код]Болезнь Гентингтона затрагивает весь мозг, но одни его части более уязвимы, чем другие. Самым ранним изменениям пордвергается часть базальных ядер, называемая неостриатумом, который состоит из хвостатого ядра и скорлупы. Другие уязвимые области включают в себя чёрную субстанцию, слои 3, 4, 5 и 6 коры больших полушарий, гиппокамп, клетки Пуркинье в мозжечке, латеральные серобугорные ядра гипоталамуса и части таламуса. Эти области затрагиваются по причине их структуры и типов нейронов, из которых они состоят, и из-за потери нейронов они уменьшаются в размерах. Средние игольчатые нейроны наиболее уязвимы, в особенности те, которые выступают в сторону внешнего бледного шара, в меньшей степени затронуты интернейроны и игольчатые нейроны, выступающие во внутрений шар.
Базальные ядра — часть мозга, которая наиболее сильно затрагивается при ранних стадиях болезни — играют основную роль в контроле двигательных функций и поведения человека. Механизмы этих функции пока не до конца понятны, но современные теории предполагают, что они являются частью когнитивной исполнительной и моторной систем. Базальные ганглии обычно ингибируют большое число схем, которые генерируют конкретные движения тела. Для инициации движения кора головного мозга посылает сигнал к базальным ганглиям, после чего возникает торможение высвобождения. Повреждение базальных ганглий может вызвать случайно и хаотическое высвобождение или восстановление торможения, что приводит к неожиданному началу движения или к остановке движения не там, где это ожидалось, что в конце концов приводит к беспорядочным движениям, связанных с БГ. Подобные спонтанные и неустойчивые физические движения классифицируются как тип гиперкинетической дизартрии. Из-за того, что контроль над подавлением движений при болезни нарушено, то у пациентов неизбежно наблюдаются проблемы с воспроизводимостью речь, глотанием пищи и жидкостей (дисфагия).
Нарушения процесса транскрипции
[править | править код]CREB-связывающий белок (CBP), который является корегулятором транскрипции, имеет важное значений для функционирования клеток, так как он является коактиватором большого числа промоутеров, которые активируют процесс транскрипции генов. Кроме того, аминокислоты, которые образуют CBP, содержат в себе 18 глутаминов. Отсюда следует, что глутамины в CBP непосредственно реагируют на увеличение числа глутамина на цепи Htt и CBP остраняется от своего обычного места рядом с ядром. В частности, CPB содержит домен ацетилтрансферазы, которые связывается с Htt через полиглутамин-содержащий домен. При вскрытии головного мозга больных было обнаружено значительное понижение количества CBP. В случае же повышенного производства CBP наблюдается уменьшение полиглутамин-индуцированной смерти, что еще раз доказывает важное влияение CBP на болезнь Гентингтона и на нейроны в целом.
Диагностика
[править | править код]Медицинская диагностика болезни может быть проделана анализом физических симптомов, специфичных для данного заболевания. Генетическое тестирование может использоваться как инструмент для подтверждения диагноза при отсутствии болезни в семейном анамнезе, впрочем, этот тест может быть выполнен и до начала возникновения симптомов для выяснения наличия или отсутствия мутантной аллели. Генетическая консультация позволит скорректировать планы на дальнейшую жизнь при положительном результате и объяснит все последствия в индивидуальной психологии, карьере, в решениях при планировании семьи и отношениях. Лишь 5% из людей, находящихся в группе риска, пользуются возможностью пресимптоматического генетического тестирования.
Клиника
[править | править код]Физикальное обследование, иногда комбинированное с психологическим тестированием, может предоставить информацию о примерном возрасте начала заболевания. Повторяемые и некотролируемые движения любой части тела часто является причиной обращения медицинской консультации. Если они резки и имеют случайный характер по времени и распределению, то в этом случае предполагается наличие болезни Гентингтона. Нарушения когнитивных функция и поведения в большинстве случае не являются начальными симптомами, они обычно обнаруживаются "задним числом" или при дальнейшем развитии заболевания. Уровень прогрессирования заболевания можно определеить с помощью универсальной шкалы уровня развития болезни Гентингтона (Unified Huntington's Disease Rating Scale, UHDRS), который является общей оценочной системой, включающая в себя анализ моторных, поведенчевских, когнитивных и функциональных возможностей. Медицинская визуализация, напр. компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), могут показать степень атрофии хвостатых ядер на ранних стадиях заболевания, как показано на рисунке справа, однако наблюдение таких изменений не дает оснований для постановки диагноза. Атрофия коры головного мозга может наблюдаться в относительно поздних стадиях болезни. Технологии функциональной нейровизуализации, напр. функциональная магнитно-резонансная томография (фМРТ) и позитронно-эмиссионная томография (ПЭТ), способны показать изменения в активности различных областей мозга еще задолго до появления первых симптомов, но на настоящий момент подобные способы визуализации остаются экспериментальными и не используются в клинических обследованиях повсеместно.
Генетическое тестирование
[править | править код]Так как болезнь Гентингтона передается аутосомно-доминантно, у людей с риском передачи мутатной аллели появляется сильная мотивация искать в себе симптомы болезни. В этом случае можно воспользоваться генетическим тестированием, имеющее большую точность и представляет из себя проверку взятой у индивида крови на проверку количества повторов ЦАГ в гене HTT. Результат может показать следующее:
- 40 и больше. Аллель с полной пенетрантностью. Данный результат считается положительным. Такой результат не означает постановку диагноза, так как тест может быть произведен еще до развития первых симптомов. С другой стороны отрицательный результат гарантирует отсутствие мутатнтной аллели и развития самой болезни. Положительный результат говорит о том, что начало болезни наступит во время жизни индивида, если он проживет достаточно долго и не умрет по другим причин. Чем выше количество повторов покажет тест, тем раньше симптомы начнут давать о себе знать.
- 36 по 39 повторов. Аллель с частичной пенетрантностью. Развитие болезни может начаться, но обычно только в очень пожилом возрасте. Максимальный шанс начала болезни к 65 годам равно 60%, а к 75 - 70%.
- 27 по 35 повторов. Аллель с пограничным значением повторов. Начала развития болезни при жизни индивида не наблюдается, однако возможно повышение числа повторов у потомков.
- 26 и меньше. Болезнь не развивается, ген устойчив и не имеет склонности к росту повторов у потомков.
Генетическое тестирование является очень сложным личным выбором, который может серьёзно повлиять на всю дальнейшую жизнь человека. Основной причиной на согласие в тестировании является возможность корректировки в решениях при дальнейшей карьере и семейных отношениях. До 1993 года подобной диагностики еще не существовало и нельзя было достаточно точно выяснить статус индивида, находящегося в группе риска. На данный момент примерно 50-70% людей в группе риска проявляют интерес в получении результатов тестирования, однако намного меньшее количество людей в действительно проходят его. Больше 95% всех индивидов отказываются от тестирования, в основном из-за понимания, что эффективного лечения этого заболевания на текущий момент не существует. Основным вопросом в этой ситуации является уровень беспокойства человека при незнании своего статуса по сравнению с получением положительного результата. Обнаружено, что уровень стресса человека при получении любого результата у человека ниже, чем у тех, кто не прошел проверку, однако повышен риск суицида после получения положительного результата. Существует и иная проблема: у человека после получения отрицательного результата может возникнуть комплекс "вины выжившего", если в семье есть носители мутантной аллели. Еще одним фактором, который принимается во внимание при рассмотрении вопроса о тестировании, является возможная дискриминация и иные последствия положительного результата, означающий, что один из родителей является носителем мутации и братья и сестры индивидуума попадают в группу риска. В одной из научных работ показано, что дискриминация по генетическому принципу обнаружено у 46% людей, находящихся в группе риска, причем, больше это наблюдается в личных отношениях, чем при оказании медицинских услуг или трудовых отношениях. Генетическая консультация может предоставить актуальную информацию, дать совет и поддержку при решении пройти тестирование и объяснить все стадии этой процедуры. Так как результаты теста могут серьезно изменить жизнь человека, все пациенты должны пройти три консультативных беседы, которые предоставят ему всю основную информацию о заболевании.
Консультирование и рекомендации по использованию генетического тестирования при болезни Гентингтона стали основной моделью для соответствующих процедур, используемые при других генетических заболеваниях, напр. аутосомно-доминатной атаксии мозжечка. Пресимптоматическое тестирование оказало влияние и на методы тестирования при поликистозе почек, болезни Альцгеймера семейного типа, раке молочной железы и прочих заболеваниях. Каждый год Европейская сеть по качеству молкулярной генетики (The European Molecular Genetics Quality Network) публикует внешние оценочные схемы качества молекулярных генетических тестов для болезни Гентингтона и разрабатывает лучшие рекомендации для помощи в их проведении и соблюдении правил отчетности и конфиденциальности результатов.
Преимплантационная генетическая диагностика
[править | править код]Эмбрионы, выращенные при помощи экстракорпорального оплодотворения, могут быть проверены на наличие мутации с помощью преимплантационной генетической диагностики. При использовании этой технологии забираются 4-8 клеток эмбриона, затем они тестируется на генетические мутации и в результате выбирается 1 или 2 здоровые клетки для дальнейшего оплодотворения. Тем сам решается проблема наследования мутантной аллели. Некоторые формы преимплантационной генетического диагностики, например, неразгласительная или сравнительная, позволяет получить успешный результат без раскрытия статуса наличия мутантной аллели в генотипе родителей. При сравнительной диагностике ДНК эмбрионов сравнивается с ДНК родителей, бабушек и дедушек для предотвращения передачи хромосомного региона, включающий в себя мутантный ген, с пораженного прародителя. При неразгласительной диагностике в матке заменяются только эмбрионы без патологии, в итоге никакая информация о родительском генотипе, а следовательно, и о риске наличия мутации не будет разглашена.
Пренатальная диагностика
[править | править код]Проверить наличие мутантной аллели можно с помощью методов пренатальной диагностики для эмбриона или плода в матке с использованием генетического материала, получаемый плацентоцентезом. Если срок беременности превышает 14-18 недель, то обычно проводят амниоцентез. С помощью этой процедуры можно узнать наличие мутации проверкой амниотической жидкости, окружающий плод. Данный вид диагностики может комбинироваться с сравнительной диагностикой, позволяющий не раскрывать данные об родительском генотипе. Пренатальная диагностика может быть проведена, если родитель:
- уже имеет симптомы болезни;
- имеет положительный результат генетического тестирования;
- попадает в группу риска с 50% вероятностью наличия мутации.
Родители должны получить консультацию о возможности прерывания беременности или трудностей у детей с положительном результате при пренатальной диагностике.
Для беременных женщин с аффектным отцом ребёнка дополнительно доступна возможность выполнения неизвазивной пренатальной диагностики, которые выполняется анализом ДНК плода, находящийся в крови женщины, получаемый взятием образца из вены, между 6 и 12 неделей беременности.
Дифференциальная диагностика
[править | править код]Порядка 99% всех постановок диагноза, основанные на типичных симптомах и семейном анамнезе, подтверждаются генетическим тестированием на наличие увеличенного количества тринуклеиновых повторов. У оставшихся наблюдаются симптомы, кооторые похожи на симптомы болезни, однако обусловлены иными причинами возникновения. Такие состояния называют вызваны БГ-подобными. Причины их возникновены неизвестны, но есть сведения, что они возникают из-за мутаций в гене прионного белка PRNP (HDL1), в гене белка юнктофилина-3 (HDL2), в неизвестном гене с рецессивным наследованием (HDL3, обнаружен только у двух семей и слабо изучен) и в гене TATA-связанного белка (SCA17, иногда называемый HDL4). Dentatorubral pallidoluysian atrophy и нейроферритинопатия, которые являются заболеваниями с аутосомно-доминатной формой наследования, также ошибочно могут быть диагностированы как болезнь Гентингтона. Существуют также заболевания с аутосомно-рецессивным наследованием, которые напоминают спорадические случаи болезни Гентингтона. К ним относятся хореический акантоцитоз и болезнь Галлервордена — Шпатца. Так же известен синдром Маклеода, который относится к этому типу, с наследованием, сцепленный с X-хромосомой.
Уход
[править | править код]К сожалению, на сегодняшний день нет эффективных препаратов в борьбе с болезнью, но существует терапия, направленная на уменьшение тяжести некоторых симптомов. Эффективность многих из таких видов лечения симптомов болезни ещё не полностью доказана. По мере того как заболевание прогрессирует, способность заботиться о себе у больного постепенно снижается и тщательно подобранный мультидисциплинарный уход становится всё более необходимым. Хотя было сделано относительно мало исследований о пользе физических упражнений и терапии для восстановления когнитивных дисфункций, есть некоторые доказательства о положительном эффекте от физической терапии, трудотерапии и работы с логопедом. Была найдена связь между употреблением кофеина и началом заболевания, но так так этот вывод был сделан на основе ретроспективных данных анкетирования, а не на рандомизированных слепых исследованиях, поэтому эта работа - не самое лучшее исследование, результаты которого следует учитывать при принятии решений об образе жизни.
Физиотерапия
[править | править код]Такие распространённые симптомы, как потеря веса и затруднённость приёма пищи, связанные с дисфагией и дискоординацией других мышц, делает процесс организации питания крайне сложным и важным по мере развития болезни. Загустители могут быть добавлены к жидкости для облегчения глотания. Для предотвращения асфиксии необходимо напоминать людям о том, что принимать пищу надо медленно и маленькими порциями. Если процесс питания становится слишком неудобным или даже опасным, возможно использование подкожной эндоскопической гастростомы в виде трубки для кормления, прочно прикрепленная через живот в желудок, которая уменьшает риск аспирации еды и обеспечивает лучшее лечебное питание. Также рекомендованы оценка и лечение у логопеда, имеющего опыт работы с пациентами с болезнью Гентингтона.
Люди с болезнью Гентингтона могут посещать физиотерапевта с назначением по получению неинвазивной и немедикаментозной терапии с целью контроля физических симптомов. Физиотерапевты могут проводить оценку риска во время движений и предотвращения падений, упражнения, направленные на укрепление, растяжение мышц, в особенности, сердца. При необходимости могут быть назначены костыли. Физиотерапевты также могуг назначить дыхательные упражнения и методики по очищению дыхательных путей при развитии респираторных проблем. Единые рекомендации в отношении физиотерапии при болезни были выработаны Европейской сетью по изучению болезни Гентингтона (European HD Network). Целью ранних мероприятий по реабилитации является предотвращение функциональных потерь организма. Участие в программах реабилитации на ранней и средней стадиях заболевания может быть полезным, поскольку это приводит к долгосрочному сохранению моторных и функциональных характеристик. Реабилитация на поздней стадии заболевания направлена больше на компенсацию двигательных и функциональных потерь. Для долгосрочного самостоятельного ухода терапевт может разработать домашние программы упражнений.
Лекарственные препараты
[править | править код]Тетрабеназин был утвержден в 2008 году в США и является первым и на данный момент единственным зарегистрированным препаратом, предназначенный для облегчения хореи при болезни Гентингтона. Другие препараты, которые помогают уменьшить проявление хореи, включают в себя нейролептики и бензодиазепины. Соединения, такие как амантадин или ремацемид, все еще исследуются, и на данный момент предварительно получены положительные результаты при их применении. Гипокинезию и ригидность, особенно в случаях ювенильного варианта болезни, можно лечить с помощью препаратов, используемых при болезни Паркинсона. Миоклонический гиперкинез можно лечить с помощью вальпроевой кислоты.
Психические симптомы можно лечить с помощью лекарств, аналогичных тем, которые используются в общей популяции. Селективные ингибиторы обратного захвата серотонина и миртазапин были рекомендованы для лечения депрессии, в то время как атипичные антипсихотические препараты рекомендуются при проявлении психоза и поведенческих проблем. Посещение психоневролога рекомендовано, поскольку для лечения пациентов может потребоваться курс длительного лечения в сочетании с несколькими препаратами.
Образование
[править | править код]Семьи, чьи члены унаследовали или подвергаются риску наследования БГ, имеют опыт нескольких поколений. Он может быть устаревшим с недостатком знаний о последних прорывах и улучшениях генетического тестирования, планирования семьи, ухода и т.д. Генетическое консультирование пойдёт на пользу таким людям, их знания обновятся, рассеются любые мифы, которые они могут иметь. Это поможет им рассмотреть их будущие возможности и планы.
Прогноз
[править | править код]Длина тринуклеиновых повторов примерно на 60% определяет возраст начала болезни и скорость её протекания. Чем протяженнее участок повторов, тем в среднем раньше наступает манифестация заболевания, а скорость их развития повышается. У лиц, имеющие более 60 повторов, болезнь часто диагностируют до наступления 20-летия, тогда как при менее, чем 40 повторах симптомы вообще могут не получить развития. Основными причинами вариативности возраста начала считаются условия окружения индивида и влияние другие генов на механизмы болезни.
Средняя продолжительность жизни после проявления первых симптомов равно примерно 20 годам. Наибольшую опасность в развитии осложнений представляют нарушения мышечной координации, в меньшей степени в изменениях поведения человека из-за нарушений когнитивных функций. Пневмония опасна в наибольшей степени, так как именно она является причиной смерти в одной трети случаев. Риск осложнения пневмонией увеличивается по мере ухудшения способность синхронизации движений, а также из-за проблем с очисткой легких и повышения опасности попаданий туда пищи или жидкостей. Вторым по опасности осложнением является сердечная недостаточность, который приводит к смерти пациентов в одной четверти случаев. Суицид стоит на третьем месте по причинам смерти: около 7.3% пациентов прерывают свою жизнь самоубийством, а 27% пытались это сделать. Не совсем ясно, по каким причинам пациенты думают о суициде: или из-за отклонений в поведении, или из-за желания избежать наступления более поздних симптомов заболевания. В прочие риски включают асфиксию, физические травмы вследствие падений и нарушения питания.
Эпидемиология
[править | править код]Позднее начало болезни Гентингтина означает, что она не влияет на воспроизводство. Во всем мире распространенность болезни составляет 5-10 случаев на 100000 человек, но в значительной степени варьируется в зависимости от географического положения из-за этнической принадлежности, локальной миграции и свойств иммиграции в прошлом. Распространённость заболевания одинакова как для женщин, так и для мужчин. Самая высокая частота встречаемости обнаружена у западноевропейских народов: в среднем около 7 случаев на 100000 человек. Встречаемость ниже для остальных частей света, так например, для взиатских и африканских народов характерен 1 случай на 1000000. Эпидемиологическое исследование 2013 года по распространенности болезни Гентингтона в Великобритании в период с 1990 по 2010 год показало, что средний показатель распространенности в этой стране составил 12,3 случаев на 100000 человек. Кроме того, некоторые локальные зоны имеют гораздо более высокую распространенность, чем в среднем по региону. Один из самых высоких показателей встречаемости обнаружен у изолированной популяции, живущей в районе рядом с озером Маракайбо в Венесуэле, где заболевание встречается в примерно 700 случаях на 100000 человек. Другие области высокой локализации были найдены в Тасмании и определённых регионах Шотландии, Уэльса и Швеции. Увеличение распространенности в ряде случаев происходит из-за локального эффекта основателя, т.е. исторической миграции носителей в области географической изоляции. С помощью генеалогических исследований некоторые из этих носителей были прослежены на сотни лет назад. Генетические гаплотипы также могут пролить свет на географическую изменчивость распространенности заболевания. К примеру, Исландия, напротив, имеет довольно низкую распространенность (1 случай на 100000 человек), несмотря на тот факт, что исландцы как народ являются потомками ранних германских племен Скандинавии, породивших также и шведов. Это справедливо для всех случаев, лишь с одним исключением, берущим начало почти два столетия назад о пары, живущей в начале 19-го века. Финляндия также имеет отсносительно низкий уровень заболеваемости — всего 2,2 на 100000 человек.
До открытия генетического тестирования статистика по частоте заболеваемости включала в себя лишь случаи с клиническим диагнозом, который был поставлен на основе физических симптомов и семейной анамнеза. В неё не входили случаи, при которых смерть наступала по ряду других причин до постановки диагноза. Случаи с доклиническим проявлением болезни в настоящее время могут быть включены в статистические данные; и, по причине того, что генетический тест становится все более широко доступным, при оценке распространенности и заболеваемости расстройства, вероятно, это величина возрастет.
История
[править | править код]Еще в Средневековье болезнь Гентингтона считали недугом, однако истинные причины его возникновения стали известны лишь относительно недавно. По мере понимания природы болезни она получала разные названия. Изначально болезнь называли просто хореей из-за характерных танцевальных движений, нередко использовались названия "наследственная хорея" или "хроническая прогрессирущая хорея". Первое конкретное упоминание о ней встречается в письме Чарли Оскара Уотерса, опубликованное в первом издании Робли Данглсона "Медицинская практика" в 1842 году. Его описание "формы хореи, просторечно названная магрумами" включало себя информацию о хорее, анализа прогрессирования и указания на явную наследственность болезни. В 1846 году Чарльз Горман обнаружил, что существуют локальные географические зоны с высокой встречаемостью заболевания.
Независимо от Гормана и Уотерса, которые были учениками Даглсона и учились в Медицинском колледже Джеферсона в Филадельфии, Джохан Кристиан Ланд в 1860 году предоставил свою версию описания. Он особо отметил норвежскую изолированную горную деревню Сетесдален, в которой обнаружилась высокая встречаемость деменции с симптомами хореистических движений у членов семей.
Первое полноценное описание заболевание было представлено Джорджом Гентингтоном в 1872 году. Изучая семейный анамнез нескольких поколений семей с симтомами хореи, он сделал вывод, что условия их возникновения должны иметь одну причину. Само описание содержало подробную и весьма точную информацию о болезни, более того, Гентингтон описал аутосомно-доминатную природу наследования болезни за годы до переоткрытия учёными законов наследования по Менделю.
У болезни наследственная природа. Если один или оба родителя находятся в стадии манифестации болезни..., то один или несколько потомков почти точно станет жертвой этого недуга ... Однако если хоть один из детей будет жить без этого, то нить обрывается и его дальнейшие правнуки и праправнуки могут быть уверены, что никогда не заболят.
Сэр Уильямс Ослер, который в общем интересовался самим расстройством и в частности хореей, был впечатлен работой Гентингтона, назвав её "одной из тех немногих работ в истории медицины, которые описывает болезнь настолько точно, настолько наглядно, но при этом очень кратко". Ослер в дальнейшем использовал свое влияние в медицинской сфере для распространения информация о болезни. Наибольший интерес показывали учёные Европы: Льюиз Теофиль Джосеф Ландузи, Дезир-Маглор Борнвилль, Камилло Голги и Джозеф Джулс Дежерин были основателями исследований болезни в Старом Свете. В концу XIX века многие учёные и исследователи многих стран опубликовали свои работы и болезнь начала изучаться уже на мировом уровне.
После повторного открытия правил наследования по Менделю на рубеже XX века болезнь Гентингтона использовалась как предварительный пример аутосомно-доминантного типа передачи. Английский биолог Уильям Бэйтсон воспользовался родословной аффектных семей для подтверждения типа наследования. Чёткая схема наследования побудила нескольких исследователей, в частности, Смита Эли Джеллиффа изучить связи между членами семей, которые участвовали в предыдущих исследованиях. Джеллифф собрал информацию по всему Нью-Йорку и опубликовал несколько работ по генеалогии болезни в Новой Англии. Эти исследования вызвали интерес Чарльза Дейвенпорта, друга Джеллиффа по колледжу. С помощью Элизабет Манси он провел первое полевое исследование родословных семей с болезнью, которые жили на Восточном побережье США. Результаты этого исследования позволили Дейвенпорту в определении возраста начала и документировании симптоматики болезни: по его словам большинство случаев в США могли привести к малой группе лиц. П. Р. Весси в 1932 году расширил это предположение: он высказал и популяризировал идею о том, что первыми носителями в США стали три брата, которые покинули Англию в 1630 году и поселились в Бостоне. Однако правильному пониманию феномена забоелвания мешали утверждения, что клетки-предшественники были созданы; евгенический уклон работ Манси, Дейвенпорта и Весси также плодили предубеждения и недоразумения о болезни. Более того, Манси и Дейвенпорт высказывали идеи о том, что в прошлом некоторые больные считались одержимыми бесами или жертвами колдовства и нередко изгонялись из общества, но эта точка зрения не получила подтверждения, наоборот, общество семей, которых изучал Гентингтон, открыто заявляло о наличии симптомов болезни у её членов.
Поиски причин заболевания получили заметный толчок в 1968 году: в это время Милтоном Векслером, психоаналитиком из Лос-Анжелеса, был основан Фонд наследственных заболеваний; причиной создания стало обнаружение симптомов болезни у жены Милтона - Леоноры Сабин. Три брата жены Векслера так же стали жертвами болезни. Фонд пригласил более 100 ученых для изучения болезни под эгидой проекта "Совместное изучение болезни Гентингтона", который в течение 10 лет работал над задачей локализации гена, отвечающий за развитие заболевания. Проект начался в 1979 в США и Венесуэле, а в 1983 году был сделан главный прорыв: нашли предварительное местонахождение гена. Этот результат удалось получить после обширного изучения популяции двух изолированных венесуэльских деревень, Барранквитас и Лагунетас, которые имели аномально высокие показатели распространенности болезни. В нем приняло участие более 18000 человек, в основном из одной большой семьи.
Среди прочих достижений этот проект разработал методы маркировки ДНК, который стали важным шагом к созданию проекта изучения генома человека (Human Genome Project). В 1993 году группа исследователей обнаружила специфический ген в участке хромосомы 4p16.3, тем самым достигнуто первое успешное нахождение локуса аутосомно-доминантной болезни с использованием средств маркировки генома.
В это же самое время ключевые исследователи сосредоточились на механизмах самой болезни, включая влияние длины гена на его течение, проверку который выполнила исследовательская группа Аниты Хардинг.
Моделирование болезни с участием некоторых видов животных, например, генетически модифицированных мышей в 1996 г., позволили расширить масштабы исследований. Из-за высокой скорости метаболизма и более короткого срока жизни по сравнению с человеком дало возможность более раннего получения необходимых результатов. В 1997 году удалось расщепить фрагменты mHtt, что позволило изучить включения в ядре, которые они вызывают. Это достижения резко увеличили скорость изучения белков, связанных с болезнью, и позволяющию разработать лекарственные препараты, медицинскую помощь и the gene itself.
Подобное состояние организма вначале называли как “Хорея Гентингтона”, но впоследствие этот термин был заменен на “Болезнь Гентингтона”. Это произошло из-за того, что болезнь не ограничивается хореей, но задевает и когнитивные и поведенческие функции человека.
Общество и культура
[править | править код]Этика
[править | править код]Возможность проведения генетического тестирования для обнаружения наличия мутатной аллели гена подняло ряд этических проблем. Общими вопросами, требущие решения при обсуждении последствий тестирования, являются:
- В каком возрасте человек может провести тестирование?
- Действительно ли человек готов к тестированию?
- Как будет обеспечиваться конфиденциальность информации?
- Имеют ли право компании получать доступ к результатам тестирования при найме на работу?
- Должны ли влиять результаты тестирования на возможности страхования жизни и решении других финансовых задач?
Сложилась противоречивая ситуация, когда Чарльз Давенпорт в 1910 году предложил принудительную стерилизацию и иммиграционный контроль для людей с определенными заболеваниями, в том числе с болезнью Гентингтона, как часть движения евгеники. Экстракорпоральное оплодотворение содержит в себе некоторые спорные вопросы относительно использования эмбрионов. Некоторые исследования болезни тоже сталкиваются с этическими проблемами в связи с испытаниями на животных и использовании эмбриональных стволовых клеток.
Развитие точной диагностики болезни Гентингтона вызвало социальные, правовые и этические опасения по поводу доступа и использования результатов пациента. Многие правила и процедуры тестирования имеют строгую процедуру о разглашении и конфиденциальности, чтобы позволить людям самим решать, когда и как получать результаты, а также кому эти результаты могут быть доступны. Финансовые учреждения и предприятия сталкиваются с вопросом о том, следует ли использовать результаты генетического тестирования при страховании жизни человека или при найме на работу. Страховые компании Соединенного Королевства согласились, что до 2017 года они не будут использовать информацию о результатах при написании страховых полисов ниже £500,000, но болезнь Гентингтона точно исключена из этого соглашения. Как и с другими неизлечимыми генетическими заболеваниями с относительно поздним началом, этически спорно проводить пресимптоматическое тестирование у ребенка или подростка, так как в таком случае исключается оплата медицинских пособий. Существует договорённость о тестировании только лиц, которые считаются совершеннолетними, хотя существует и контраргумент, что родители имеют право принимать решение от имени своего ребенка. При отсутствии эффективного лечения тестирование лица, не достигшего установленного законом возраста совершеннолетия, неуполномоченным лицом считается неэтичным в большинстве случаев.
Существуют иные этические проблемы, связанные с пренатальной или предимплантационной диагностикой, которые редоставляют возможность развития ребенка без данного заболевания. Например, пренатальное тестирование поднимает вопрос о селективных абортах, для некоторых такой выбор неприемлем. Поскольку болезнь является доминантным заболеванием, возникают трудности в ситуациях, в которых один из родителей не хочет знать свой собственный статус.
Общественные организации
[править | править код]В 1968 году Милтон Векслер начал основание Фонда наследственных заболеваний для координации и поддержки разработок по лечению генетических заболеваний. Основной причиной создания фонда стало обнаружение болезни Гентингтона у семьи жены Векслера. Этот фонд, совместно с Нэнси Векслер, дочерью Милтона Векслера, принял ключевое участие в исследовании в Венесуэле, где были обнаружены общины с высокой встречаемостью заболевания.
Примерно в это же время после смерти известного музыканта Вуди Гатри из-за осложнений, вызванных заболеванием, Маджори Гатри приняла непосредственное участие в основании Комитета по борьбе с болезнью Гентингтона, который сейчас имеет название "Американской ассоциации пациентов с болезнью Гентингтона".
С этого времени подобные организации начали появляться в различных странах, которые решают проблемы информирования общественности о болезни. Многие из них объединяют свои усилия и образовывают ассоциации, такие как "Международная ассоциация по болезни Гентингтона" и "Европейская сети изучения болезни Гентингтона". Большое количество общественных организаций проводят ежегодные просветительские встречи и конференции, некоторые из которых поддерживаются соответствующими правительствами К примеру, в США решением Сената 6 июля стал Национальным днем просвещения о болезни Гентингтона.
На сегодняшний момент самой крупной в точки зрения финансовых затрат некоммерческой организацией, которая занимается разработками методов лечения, является Фонд CHDI (CHDI Foundation), который базируется в США. Их основной задачей является "быстрое нахождение и разработка лекарств, которые могли бы замедлить либо полностью остановить развитие болезни". CHDI в прошлом имел название Фонда High Q. В 2006 году на изучение болезни этой организацией было потрачено $50 млн. Это фонд активно сотрудничает с большим количеством государственных и коммерческих научных лабораторий и участвует в управлении различных научно-исследовательских проектов.
Направление исследований
[править | править код]Исследования, изучающие болезнь Гентингтона, пытаются выяснить функции белка mHtt, чем он отличается от обычного варианта и как он препятствует работе последнего, а также какие патологии возникают в головном мозге во время жизни человека и при эмбриональном развитии. В основном, исследования проводятся in vitro, на животных моделях и с учатием волонтеров. Животные модели позволяют понять базовые механизмы возникновния болезни и разработать поддерживающие медицинские препараты при ранних стадиях болезни. Животные, у которых химическим образом повреждены части мозга, затрагиваемые заболеванием, начинают испытывать похожие симптомы, однако они не обладают свойством прогрессирования болезни. Обнаружение локализации гена позволяет создать модели генетически модифицированных животных, включающих в себя червей-нематодов, мушек-дрозофил, мышей, кроликов, овец, свиней и обезьян, которые вырабатывали бы мутантный вариант белка Htt и позволили бы наблюдать за прогрессированием симптомов и на степень нейродегенерации.
Большое количество исследований концентрируются на разработке механизмов остановки развития болезни или его замедления. Стратегии терапии болезни можно разделить на три основные группы:
- уменьшение уровня экспрессии мутантного гена (включая технологии подавления экспресии генов);
- техники повышения выживаемости нейронов для нивелирования повреждений мутантным белком с помощью специфичных клеточных механизмов (включая белковый гомеостаз и ингибирование хистон-дисетилазы);
- стратегии восстановления потерянных нейронов с помощью терапии с использованием стволовых клеток.
Кроме этого, в разработке находятся методы терапии улучшения деятельности мозга, в частности, улучшение процессов межклеточной коммуникации; они больше являются симптоматическими и включают в себя технологии ингибирования фосфодистеразы.
Уменьшение производства гентингтина
[править | править код]В большинстве случаев болезнь Гентингтона возникает из-за наличия варианта гена, который вырабатывает токсичный белок. С помощью технологии подавления экспрессии генов можно уменьшить выделение этого токсичного белка. Проверки на мышах показали, что при уменьшении экспресии белка mHtt снижается степень выраженности симптомов. Безопасность аллель-неспецифичных вариантов подавления экспресси генов, например, RNAi и ASO, показана на мышах и на приматах, размер и структура которых похожи на человеческий. Аллель-специфичные варианты блокируют выделение белка mHtt, не затрагивая работу нормальной аллели. Одним из путей реализаций этих технологий является использование полиморфизма - точечных изменений в геноме, которые выявляются у определенной аллели, и лекарства на базе этого явления должны детектировать эти изменения только в мутантном гене. Первым подобным препаратом, тестирование безопасности которого на людях началось в октябре 2015 года, называется IONIS-HTTRx, разработанный компанией Ionis Pharmaceuticals совместно с Roches и Институтом Неврологии UCL.
Улучшение выживаемости клеток
[править | править код]Некоторые исследования посвящены работе над методами терапии на основе стволовых клеток для замены нейронов в поврежденных частях головного мозга. Эксперименты, проведенные на животных моделях и предварительных клинических исследованиях на людях, показали неоднозначные результаты. Несмотря на этот факт, у данных методов лечения имеется огромный потенциал развития и уже сейчас они являются важным инструментов изучения болезни в лабораторных условиях.
Клинические исследования
[править | править код]На данный момент проводятся несколько клинических исследований с тестированием экспериментальных лекарственных препаратов и методов лечения, которые планируются использовать в терапии болезни Гентингтона. Исследования многих веществ и соединений, таких как ремацемид, кофермент Q, рилузол, креатин, миноциклин, этил-эйкозапентаеновая кислота, фенилбутират и латрепирдин, не показали статистически значимого положительного результата по замедлению развития болезни.
Ссылки
[править | править код]- ↑ Huntington's Disease Information Page: National Institute of Neurological Disorders and Stroke (NINDS). NINDS (28 января 2016). Дата обращения: 2 августа 2016.
- ↑ Dayalu, P; Albin, RL. Huntington disease: pathogenesis and treatment. // Neurologic Clinics. — 2015. — Февраль (т. 33, № 1). — С. 101-104. — doi:10.1016/j.ncl.2014.09.003. — PMID 25432725.
- ↑ Warby, SC; Graham, RK; Hayden, MR; Pagon, RA; Adam, MP; Ardinger, HH; Wallace, SE; Amemiya, A; Bean, LJH; Bird, TD; Fong, CT; Mefford, HC; Smith, RJH; Stephens, K. Huntington Disease. — 2014. — PMID 20301482.
- ↑ Frank, S. Treatment of Huntington's disease. // Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics. — 2014. — Январь.
