Хромон
| Хромон | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хромен-4-он |
| Традиционные названия | 4-Хромон; 1,4-Бензопирон; 4H-Хромен-4-он; Бензо-γ-пирон; 1-Бензопиран-4-он; 4H-Бензо(b)пиран-4-он |
| Хим. формула | C9H6O2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 146,145 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 59 °C |
| • кипения | 239 °C |
| Химические свойства | |
| Константа диссоциации кислоты | -2.0 (сопряженная кислота) |
| Растворимость | |
| • в воде | малорастворим |
| • в хлороформе | растворим |
| • в этаноле | растворим |
| • в диэтиловом эфире | растворим |
| Классификация | |
| Рег. номер CAS | 491-38-3 |
| PubChem | 10286 |
| Рег. номер EINECS | 207-737-9 |
| SMILES | |
| InChI | |
| RTECS | GB7887000 |
| ChEBI | 72013 |
| ChemSpider | 9866 |
| Безопасность | |
| ЛД50 | 91 мг/кг (мыши, внутрибрюшинно) |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромо́н (или бензо-4-пиро́н) — гетероциклическое органическое соединение, производное бензопирана с кето-группой в положении 4 пиранового кольца. Хромон является основой структуры флавоноидов; кроме того, производные хромона, не являющиеся флавоноидами, распространены в растительном и бактериальном мирах. Хромон считается перспективным структурным блоком для поиска новых фармацевтических субстанций.[1]
Исторические сведения
[править | править код]Название «хромон» было впервые использовано М. Блохом и С. Костанецким для описания окрашенных природных соединений, содержащих в структуре бензопиран-4-оновый фрагмент.[2] Незамещенный хромон был впервые получен С. Руэманном и Х. Стэплтоном в 1900 году пиролизом 2-хромонкарбоновой кислоты, полученной, в свою очередь, ими же из феноксифумаровой кислоты.[3]
Физические свойства
[править | править код]В УФ спектре хромона наблюдаются максимумы поглощения при 245 (ɛ=10000) и 297 (ɛ=6460) нм, в ИК-спектрах хромона валентным колебаниям карбонильной группы соответствует полоса поглощения 1660 см−1[4]. Большинство хромонов флуоресцируют в УФ-свете желтым или желто-зеленым цветом. Интенсивность флуоресценции усиливается под воздействием паров аммиака или после обработки спиртовыми растворами щелочей. В отличие от кумаринов, хромоны усиливают флуоресценцию в УФ-свете после обработки серной кислотой.
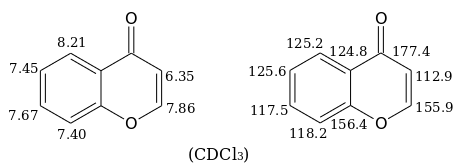
В спектрах ЯМР 1H и 13С хромона в дейтерохлороформе наблюдаются следующие сигналы (в миллионных долях):[5]
В масс-спектре хромона, помимо молекулярного иона М+. с m/z 146, наблюдаются пики продуктов фрагментации, сопровождающейся выбросом молекулы ацетилена, а затем двух молекул СО в соответствии со схемой:[6]

Методы синтеза
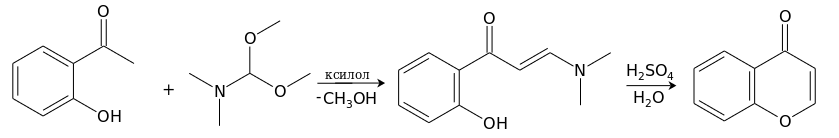
[править | править код]Удобный метод получения хромона основан на реакции о-гидроксиацетофенона с диметилацеталем диметилформамида в кипящем ксилоле с одновременной отгонкой образующегося метанола. Получающийся енаминокетон под действием водного раствора серной кислоты при 100°С циклизуется в хромон. [7]
Исторически, для получения 2- и 3-замещенных хромонов также широко распространены методы синтеза путем конденсаций с использованием производных о-гидроксиацетофенона, но к настоящему времени известно и множество других подходов к их синтезу.[8][9][10] Большое значение сохраняют реакция Костанецкого[англ.] и перегруппировка Бейкера-Венкатарамана[англ.]
Химические свойства
[править | править код]Кислотно-основные свойства
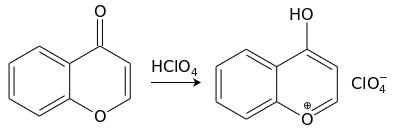
[править | править код]С сильными кислотами (например, хлорной) хромон образует cоли пирилия[англ.] (хромилия) лимонно-желтого цвета:[11]
Фотохимические реакции
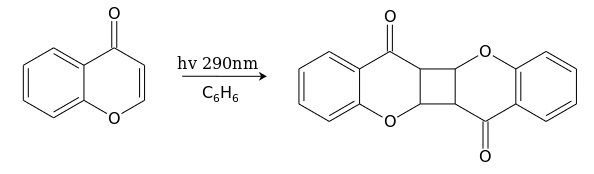
[править | править код]При облучении УФ светом бензольного раствора хромона он димеризуется, образуя продукт типа «голова-к-хвосту»: [12]
Взаимодействие с нуклеофилами
[править | править код]Хромон довольно легко вступает в реакции со многими нуклеофилами. Эти реакции чаще всего протекают по положению С(2) и сопровождаются раскрытием пиронового кольца. Так, холодный раствор гидроксида натрия обратимо превращает хромоны в соли соответствующих ациклических производных фенола в результате атаки по положению С(2). Продукты реакций с концентрированными щелочами обычно окрашены в пурпурно-красный цвет.
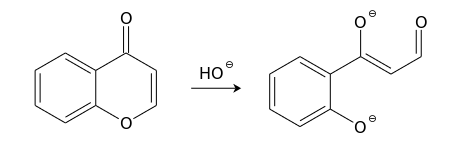
В более жестких условиях наблюдается разрушение 1,3-дикарбонильного бокового фрагмента такого производного фенола (превращение, обратное конденсации Клайзена).
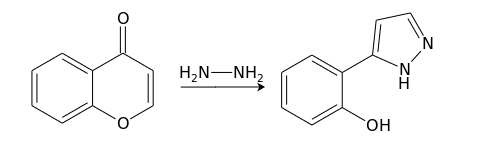
Взаимодействие с бинуклеофилами, например, гидразином, протекает через атаку по положению С(2), дециклизацию, и вторичную атаку по С(4) с формированием 5-замещенного пиразола:
Взаимодействие с электрофилами
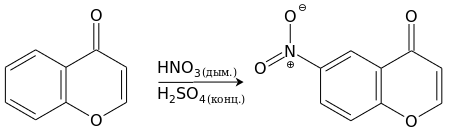
[править | править код]Хромон труднее вступает в реакции с реагентами электрофильной природы, и они почти всегда проходят, не затрагивая пироновый фрагмент. Нитрование хромона дымящей азотной кислотой в присутствии концентрированной серной кислоты приводит с хорошим выходом к 6-нитрохромону.[13]
Бромирование дибромизоциануровой кислотой идёт уже при комнатной температуре и также приводит к 6-замещённому производному.[14]
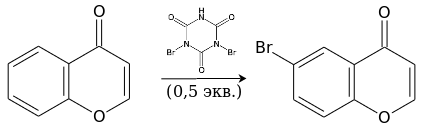
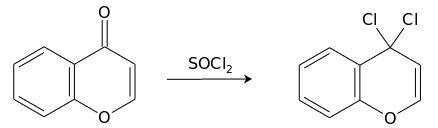
Прочие реакции
[править | править код]Реакцией хромона с тионилхлоридом может быть получен продукт замещения кислорода кето-группы.[15]
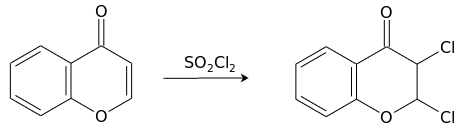
Взаимодействие с сульфурилхлоридом приводит к продукту присоединения хлора по двойной связи пиронового кольца, 2,3-дихлорхроманону.[15]
Отличия от кумаринов и флавоноидов
[править | править код]Производные хромона от производных кумарина отличают при помощи реакции азосочетания, например с диазотированной сульфаниловой кислотой. Хотя хромоны в фильтрованном ультрафиолетовом свете характеризуются сходной с некоторыми кумаринами флуоресценцией, с диазореагентами они образуют в растворах светло-желтое окрашивание, а на бумаге этой реакции вообще не обнаруживается, в то время как продукты взаимодействия кумаринов с солями диазония имеют устойчивую окраску, которая, в зависимости от строения кумарина и диазореагента, может меняться от оранжевой до красной.[16] В отличие от флавоноидов, хромоны не дают окраски со смесью борной и лимонной кислот. [11]
Специфическая качественная реакция
[править | править код]При взаимодействии с 0,1 % водным раствором уранилацетата хромоны, в зависимости от структуры, образуют окрашенные растворы (оранжевые, красные, фиолетовые) или желтый осадок.
Производные хромона в природе и фармакологии
[править | править код]Замещенные хромоны широко распространены в природе. В течение суток с растительными продуктами человек потребляет около 140—190 мг различных производных хромона, главным образом, флавоноидов[17]. Многие флавоноиды, а также производные хромона, выделенные из растений и низших грибов, обладают противоопухолевой, фунгицидной, антиоксидантной, Р-витаминной и др. видами биологической активностьи. Синтетические производные хромона также используются в качестве фармпрепаратов.
- Келлин[англ.] и Виснагин[англ.] — представители фурохромонов, содержащиеся в плодах, листьях, корнях и стеблях Ammi visnaga. Келлин используется как спазмолитическое и седативное средство при стенокардии и бронхиальной астме. Виснагин обладает вазодилаторной активностью и применяется в народной медицине для профилактики образования почечных камней.[18]
- Кверцетин, витаминный препарат группы Р, антиоксидант.
- Рутин, гликозид кверцетина (кверцетин-3-О-рутинозид), входит в состав препарата «Аскорутин».
- Интал (натриевая соль кромоглициевой кислоты) — противоаллергическое и противоастматическое средство для профилактики и лечения бронхиальной астмы, аллергического ринита и конъюнктивита.[19]
- Недокромил[англ.] натрия — противоастматическое средство.
- Эукрифин — гликозид, выделенный из коры Eucryphia cordifolia.[20]
- Амлексанокс[англ.] — противовоспалительное средство, применяющееся для лечения афтозного стоматита.
См. также
[править | править код]Ссылки
[править | править код]- ↑ Reis J, Gaspar A, Milhazes N, Borges F (2017). "Chromone as a Privileged Scaffold in Drug Discovery: Recent Advances". J. Med. Chem. 60: 7941—7957. doi:10.1021/acs.jmedchem.6b01720.
{{cite journal}}: Недопустимый|display-authors=4(справка) - ↑ G.P. Ellis, Chromenes. Chromanones and Chromones, John Wiley and Sons, New York, 1977.
- ↑ Ruhemann S, Stapletone HE (1900). "Condensation of Phenols with Esters of the Acetylene Series. Part III. Synthesis of Benzo-γ-pyrone". J. Chem. Soc. 77: 1179. doi:10.1039/CT9007701179.
{{cite journal}}: Недопустимый|display-authors=2(справка) - ↑ J. Staunton, in Comprehensive Organic Chemistry, D. Barton and W.D. Ollis, Eds. Pergamon Press, Oxford, 1974, Vol. 4, p. 659.
- ↑ Stubbing LA, Li FF, Furkert DP, Caprio VE, et al. (2012). "Access to 2-alkylchromanones via a conjugate addition approach". Tetrahedron. 68 (34): 6948—6956. doi:10.1016/j.tet.2012.05.115.
- ↑ Н.С. Вульфсон, В.Г. Заикин, А.И. Микая. Масс-спектрометрия органических соединений. − М. Химия, 1986. − Стр. 219.
- ↑ Л. Физер, М. Физер. Реагенты для органического синтеза. − Т. 7. − М.: Мир, 1978. − C. 173.
- ↑ Chromone and flavone synthesis. Дата обращения: 9 сентября 2022. Архивировано 9 сентября 2022 года.
- ↑ Джоуль Дж., Миллс К. Химия гетероциклических соединений. − 2-е изд., перераб. − Пер. с англ. Ф.В. Зайцевой и А.В. Карчава. − М.: Мир, 2004. − С. 236-245.
- ↑ Гетероциклические соединения. − Т. 2. − Под редакцией Р. Эльдерфильда. − М.: Издательство Иностранной литературы, 1954. − С. 177-193.
- ↑ 1 2 Фармакогнозия. Учебное пособие — Карпук В.В. – Минск: 2011 − С. 231
- ↑ Sakamoto M, Kanehiro M, Minoa T, Fujita T (2009). "Photodimerization of chromone". Chem. Comm. 45 (17): 2379—2380. doi:10.1039/B822829A.
{{cite journal}}: Недопустимый|display-authors=4(справка) - ↑ Goldberg AA, Walker HA (1953). "Synthesis of diaminoxanthones". J. Chem. Soc. 1953 (0): 1348—1357. doi:10.1039/JR9530001348.
{{cite journal}}: Недопустимый|display-authors=2(справка) - ↑ Ellis GP, Thomas IL (1973). "Benzopyrones. Part X. Bromination of chromones and coumarins with dibromoisocyanuric acid. Nitrations of chromones". J. Chem. Soc., Perkin Transactions I. 1973 (0): 2781—2785. doi:10.1039/P19730002781.
{{cite journal}}: Недопустимый|display-authors=2(справка) - ↑ 1 2 Tsvetkova ID, Orlova EK, Zagorevskii VA (1967). "Research on pyranes, their analogs, and related compounds XXIII. Reaction of 4,4-dichlorochromene and 3,4,4-trichlorochromene with nucleophilic reagents". Chem. Het. Compds (USSR). 1967 (3): 624—626. doi:10.1007/BF00468328.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ Технология и стандартизация лекарств. Сборник научных трудов. − Под ред. акад. ИА Украины В. П. Георгиевского и профессора Ф. А. Конева − ООО «РИРЕГ», 1996. − С. 75-76.
- ↑ Vogiatzoglou A, Mulligan AA, Lentjes MA, Luben RN, Spencer JP, Schroeter H, et al. (2015). "Flavonoid intake in European adults (18 to 64 years)". PLOS ONE. 10 (5): e0128132. Bibcode:2015PLoSO..1028132V. doi:10.1371/journal.pone.0128132. PMC 4444122. PMID 26010916.
- ↑ Abdel-Aal, E.A.; Daosukho, S.; El-Shall, H. (2009). "Effect of supersaturation ratio and Khella extract on nucleation and morphology of kidney stones". Journal of Crystal Growth. 311 (9): 2673. Bibcode:2009JCrGr.311.2673A. doi:10.1016/j.jcrysgro.2009.02.027.
- ↑ HOWELL, J.B. & ALTOUNYAN, R.E. (1967). A double-blind trial of disodium cromoglycate in the treatment of allergic bronchial asthma. Lancet, 2, 539—542. Abstract
- ↑ Eucryphin, a new chromone rhamnoside from the bark of Eucryphia cordifolia. R. Tschesche, S. Delhvi, S. Sepulveda and E. Breitmaier, Phytochemistry, Volume 18, Issue 5, 1979, pages 867—869, doi:10.1016/0031-9422(79)80032-1
